Χειρουργική θεραπεία στην νόσο Πάρκινσον
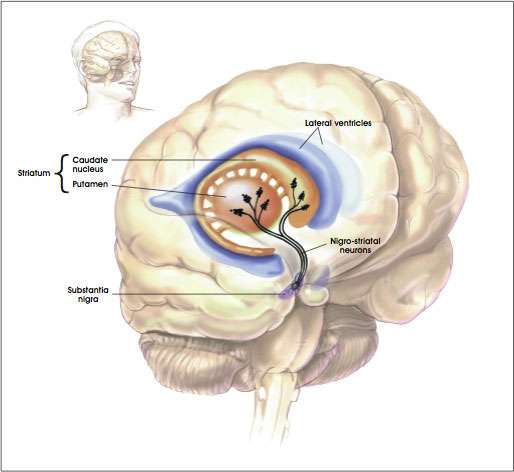
Από την ιδιοπαθή νόσο του Πάρκινσον πάσχουν περίπου 4.000.000 άτομα στον κόσμο. Στις ΗΠΑ υπολογίζεται ότι υπάρχουν 1.000.000 ασθενείς με νόσο Πάρκινσον, ενώ καταγράφονται 60.000 νέες περιπτώσεις κατ’ έτος. Επειδή ο μέσος όρος ζωής αυξάνεται υπολογίζεται ότι η συχνότητα της νόσου θα αυξηθεί 4 φορές έως το 2040. Η μέση ηλικία εμφάνισης του προβλήματος είναι τα 60 έτη. (1,2) Ως αίτιο της νόσου θεωρείται η προοδευτική εκφύλιση των ντοπαμινεργικών νευρώνων στη μέλαινα ουσία, που παράγει την απαραίτητη ντοπαμίνη για την ρύθμιση λειτουργίας των βασικών γαγγλίων. Απαιτείται 60-70% εκφύλιση των νευρώνων αυτών ώστε να εμφανιστεί η νόσος.
Εν τω βάθει ηλεκτρικός ερεθισμός (DBS- deep brain stimulation)
Η επανάσταση στα αποτελέσματα της χειρουργικής της ν. Πάρκινσον έγινε στην δεκαετία του ΄90, με την εισαγωγή της Μαγνητικής τομογραφίας και την βελτίωση της τεχνολογίας των βηματοδοτών. Ο εν τω βάθη εγκεφαλικός ερεθισμός (Deep Brain Stimulation) με υψηλής συχνότητας ηλεκτρικά ερεθίσματα (high frequency stimulation ) αποτελεί πλέον μια ταχύτατα αναπτυσσόμενη χειρουργική τεχνική για την συμπτωματική θεραπεία των κινητικών παθήσεων (ν.Πάρκινσον, δυστονίαs, ιδιοπαθούς τρόμου). Το ηλεκτρικό ερέθισμα έχει συγκεκριμένη συχνότητα (90-180 Hz), ένταση (0,1-10 volts) και εύρος (60-450 msec). Η τεχνολογία αυτή βασίζεται στην εισαγωγή με στερεοτακτική μέθοδο και τοπική αναισθησία, ενός ηλεκτροδίου σε κάποιον πυρήνα του εγκεφάλου (θάλαμος, ή ωχρά σφαίρα, ή υποθαλάμιος πυρήνας) και την συνεχή διέγερση με ρεύμα που προέρχεται από ένα συσωρευτή (μπαταρία) τοποθετημένη στο πρόσθιο θωρακικό τοίχωμα (Photo 1). Το ηλεκτρόδιο έχει 4 πόλους, καθένας απο τους οποίους δρά σαν άνοδος ή κάθοδος επιτρέποντας την εκπομπή ή την λήψη του ηλεκτρικού ερεθίσματος. Η αλλαγή της πολικότητας του ηλεκτροδίου (που γίνεται με φορητό υπολογιστή από τον θεράποντα) επιφέρει τροποποίηση των συμπτωμάτων του ασθενούς. Η εμφύτευση του ηλεκτροδίου γίνεται βάσει συντεταγμένων στην μαγνητική τομογραφία καθώς και με την βοήθεια διεγχειρητικής διέγερσης (corticospinal localization). Πρώτος ο Mundinger (1977) χρησιμοποίησε την εν τω βάθει ηλεκτρική διέγερση του εγκεφάλου και παρουσίασε τα πρώτα αποτελέσματα χρησιμοποιώντας ενδοεγκεφαλικά ηλεκτρόδια σε ασθενείς με ραιβόκρανο, χρόνιο πόνο και κινητικές παθήσεις (17). Αργότερα ο Benabid (1990) χρησιμοποίησε την θεραπευτική αυτή τεχνική για την συμπτωματική αγωγή του τρόμου, με τοποθέτηση του ηλεκτροδίου στον θάλαμο (Vim DBS) καθώς και άλλων παρκινσονικών συμπτωμάτων με τοποθέτηση του ηλεκτροδίου στον υποθαλάμιο πυρήνα (15,16). Ο μηχανισμός δράσης του εν τω βάθει εγκεφαλικού ερεθισμού παραμένει άγνωστος. Υπάρχουν πολλές θεωρίες βασισμένες σε μελέτες σε πειραματόζωα και σε διεγχειρητική διέγεση σε ανθρώπους. Μια υπεραπλουστευμένη θεωρία υποστηρίζει ότι η δράση της μεθόδου ασκείται μέσω νευρωνικής αναστολής . Υψηλής συχνότητας ερεθίσματα προκαλούν αναστολή σε πυρήνες (ωχρά σφαίρα, θάλαμος, υποθαλάμιος πυρήνας), ενώ χαμηλής συχνότητας ερεθίσματα προκαλούν διέγερση. Όταν διεγείρονται νευρωνικοί άξονες το αποτέλεσμα είναι διέγερση ανεξάρτητα αν το ηλεκτρικό ερέθισμα είναι χαμηλής ή υψηλής συχνότητας. Στην περίπτωση χρόνιας διέγερσης του θαλάμου πιθανολογείται η διακοπή του κυκλώματος που προκαλεί τον τρόμο (jamming of the feedback loop). Στην χρόνια διέγερση του υποθαλάμιου πυρήνα η δράση πιθανώς ασκείται μέσω νευρωνικής καταστολής στον πυρήνα (decrease of neuronal activity ή ακόμα και depolarization block ). Στην χρόνια διέγερση της ωχράς σφαίρας πιθανολογείται η δράση μέσω ορθο-και αντίδρομου ερεθισμού των προσαγωγών αξόνων ή και ερεθισμός των απαγωγών αξόνων (activation of inhibitory structures).
Οι πιο δημοφιλείς σήμερα χειρουργικές επεμβάσεις για την θεραπεία των συμπτωμάτων της νόσου Πάρκινσον είναι : α. Οπίσθια κοιλιακή ωχροτομή (GPi pallidotomy), β. Θαλαμοτομή (Vim thalamotomy), γ. Εν τω βάθη εγκεφαλική ηλεκτρική διέγερση (Deep Brain Stimulation –DBS) στην ωχρά σφαίρα, στον θάλαμο ή στον υποθαλάμιο πυρήνα. Υπάρχουν επιπλέον ορισμένες μέθοδοι που εφαρμόζονται σε συγκεκριμένα νευροχειρουργικά κέντρα (ΗΠΑ, Γαλλία, Σοβιετική ένωση), όπως οι μεταμοσχεύσεις, αλλά βρίσκονται ακόμα σε πειραματικό στάδιο.
Ενδείξεις χειρουργικής επέμβασης
Τα τελευταία χρόνια υπάρχει σχετική ομοφωνία σχετικά με τις ενδείξεις της συμπτωματικής θεραπείας της ν. Πάρκινσον :
1. Η ωχροτομή και η εν τω βάθει διέγερση της ωχράς σφαίρας (Gpi-DBS) ενδείκνυται στις υπερκινησίες και στην δυστονία, είναι δε λιγότερο αποτελεσματική στον τρόμο και την βραδυκινησία.
2. Η θαλαμοτομή και η διέγερση του θαλάμου (Vim-DBS) ενδείκνυται για την καταστολή του Παρκινσονικού τρόμου.
3. Η χρόνια διέγερση του υποθαλάμιου πυρήνα (STN DBS) ενδείκνυται για την καταστολή όλων των συμπτωμάτων της νόσου (τρόμου, δυσκαμψίας, βραδυκινησίας).
Επιλογή είδους χειρουργικής επέμβασης
Η επέμβαση μπορεί να είναι μια απλή θερμοτομή στον πυρήνα που αποφασίσαμε (με επιπλοκές συνήθως μη αναστρέψιμες), ή καταστολή του πυρήνα με εν τω βάθει ηλεκτρισμό (DBS) που προσφέρει την δυνατότητα αναστροφής των τυχόν παρενεργειών και επιπλοκών. Θα πρέπει να υπολογίσει κανείς ότι η εμφύτευση μόνιμων εγκεφαλικών ηλεκτροδίων και του νευροδιεγέρτη (IPG) αυξάνει το κόστος της επέμβασης και προσθέτει έναν επιπλέον κίνδυνο επιπλοκών (6-13%) που σχετίζονται με το μηχανικό μέρος της μεθόδου(φλεγμονή, μετακίνηση ηλεκτροδίου, διακοπή του κυκλώματος). Οι επιπλοκές αυτές θεωρούνται ήπιες και αντιμετωπίζονται σχετικά εύκολα.
Ο ασθενής που θα επιλεγεί να υποβληθεί σε εμφύτευση νευροδιεγέρτη πρέπει να είναι συνεργάσιμος και υπομονετικός. Η ομαλοποίηση των συμπτωμάτων του θα απαιτήσει χρόνο 1-3 μηνών.
Κριτήρια επιλογής ασθενών
Η επιλογή του κατάλληλου ασθενούς απαιτεί συνεργασία του νευρολόγου, του νευροχειρουργού, του νευροψυχολόγου και του ψυχιάτρου.. Ο νευρολόγος αρχικά είναι υπεύθυνος για να προτείνει έναν ασθενή ως υποψήφιο για χειρουργική θεραπεία. Ουσιαστικά ο νευρολόγος καθορίζει την αναγκαιότητα μιας επέμβασης υποδεικνύοντας την σωστή διάγνωση και εξαντλώντας τα όρια της φαρμακευτικής αγωγής. Στην συνέχεια ο νευροψυχολόγος και ο ψυχίατρος θα πρέπει να αποκλείσουν τους ασθενείς που παρουσιάζουν άνοια ή ψυχική νόσο. Τέλος, ο νευροχειρουργός θα πάρει την ευθύνη και θα αποφασίσει αν η επέμβαση είναι εφικτή και θα καθορίσει τον τύπο της χειρουργικής επέμβασης (χρόνια διέγερση του εγκεφάλου ή θερμοτομή και πρόκληση μόνιμης βλάβης σε κάποιον πυρήνα).(Πίνακας 1.)
Θα πρέπει επίσης να εξηγήσει στον ασθενή τα ωφέλη και τις πιθανότητες επιπλοκών από το χειρουργείο. Λαμβανομένου υπόψιν ότι, 4-8 % των ασθενών που παραπέμπονται σε οργανωμένα κέντρα με αρχική διάγνωση ν. Πάρκινσον πάσχουν από άλλα ακινητικά σύνδρομα (ν. Steele-Richardson, ατροφία πολλαπλών συστημάτων, αγγειακής αιτιολογίας ν. Πάρκινσον, κτλ), ο νευρολόγος και ο νευροχειρουργός πρέπει να έχουν εμπειρία σε ασθενείς με διαταραχές κινητικότητας. Η ομάδα των ιατρών αυτών θα πρέπει να είναι σε θέση να αποκλείσει ασθενείς όπου η διάγνωση της ν. Πάρκισον δεν τίθεται με βεβαιότητα. Μετεγχειρητικά οι ασθενείς πρέπει να παρακολουθούνται από τον θεράποντα νευρολόγο και συχνά απαιτείται αλλαγή στην δοσολογία των φαρμάκων, συνεπώς ο ασθενής πρέπει να έχει την διάθεση και την υπομονή να συνεργαστεί με τον ιατρό του. Οι υποψήφιοι για την χειρουργική θεραπεία πρέπει να πληρούν τις εξής προυποθέσεις (23) (Πίνακας 2)
Κριτήρια αποκλεισμού από την Χειρουργική θεραπεία
Πρέπει να υπολογίσει κανείς ότι μόνο 5-10% των ασθενών με ν. Πάρκινσον επιλέγονται τελικά για χειρουργική θεραπεία. Τα κυριότερα κριτήρια αποκλεισμού από την χειρουργική θεραπεία είναι τα εξής (23) (Πίνακας 3.)
Χρόνια διέγερση του υποθαλάμιου πυρήνα (STN DBS)
Στην ν. Πάρκινσον ο υποθαλάμιος πυρήνας θεωρείται ότι βρίσκεται σε υπερδιέγερση.Ο υποθαλάμιος πυρήνας ασκεί διεγερτική δράση (γλουταμινεργική) στην ωχρά σφαίρα και στην μέλαινα ουσία (SNr). Η ωχρά σφαίρα με την σειρά της ασκεί ανασταλτική δράση στον θάλαμο (GABA- mediated) με αποτέλεσμα μείωση της διέγερσης του φλοιού (με συνέπεια τη βραδυκινησία). Ελαττώνοντας την υπερλειτουργία του υποθαλάμιου πυρήνα ( με χρόνιο εν τω βάθει εγκεφαλικό ερεθισμό) ελαττώνουμε την ανασταλτική δράση στο επίπεδο του θαλάμου, άρα αυξάνουμε την διέγερση του φλοιού του εγκεφάλου (και μειώνεται η βραδυκινησία). Η αμφοτερόπλευρη διέγερση του υποθαλάμιου πυρήνα έχει αναδειχθεί σαν επέμβαση εκλογής σε πολλά κέντρα στην Ευρώπη, Καναδά και πρόσφατα στις ΗΠΑ. Φαίνεται ότι προσφέρει βελτίωση της δυσκαμψίας (50-68% σε κατάσταση -off και 30-50% σε κατάσταση -on), βελτίωση της βραδυκινησίας (25-71% σε -off και 12% σε -on), βελτίωση του τρόμου (74-97% σε -off και 43% σε -on), με μέση βελτίωση του κινητικού σκέλους του UPDRS 60-75% σε κατάσταση -off και 10-80% σε κατάσταση –on. Επιτρέπει την σταδιακή μείωση της L-dopa κατά 40-55% (24,25,26,27).
Ως αναστρέψιμες και παροδικές επιπλοκές της διέγερσης του συγκεκριμένου πυρήνα αποτελούν οι διαταραχές της ψυχικής σφαίρας (μανία ή κατάθλιψη), διαταραχές της οφθαλμοκινητικότητας, σύγχυση περιεγχειρητική, βαλλιστικές κινήσεις, δυσκινησίες, συσπάσεις μυικών ομάδων (λόγω ερεθισμού της έσω κάψας). Λιγότερο αναστρέψιμες θεωρούνται η επίδραση στην φωνή (επιβάρυνση της υποφωνίας λόγω της ελάττωσης μετεγχειρητικά της L-dopa) και η βλεφαρόπτωση (eyelid apraxia).
Η ομαλοποίηση των συμπτωμάτων του ασθενούς μετά από εμφύτευση στον υποθαλάμιο πυρήνα απαιτεί διάστημα τουλάχιστον 2-3 μηνών, με επισκέψεις ανά 1-2 εβδομάδες. Στο διάστημα αυτό ο νευρολόγος ή ο νευροχειρουργός θα πρέπει να βρουν αρχικά το συνδυασμό της πολικότητας των ηλεκτροδίων που είναι κατάλληλος για τον συγκεκριμένο ασθενή, κατόπιν να ελαττώσει σταδιακά την L-dopa ώστε να αποφύγει τις δυσκινησίες, και να αυξήσει την ισχύ του ηλεκτρικού ερεθίσματος ώστε να επιτύχει την ελάττωση της ακινησίας και του τρόμου.
Σαν συμπέρασμα μπορούμε να πούμε ότι η χρόνια διέγερση του υποθαλάμιου πυρήνα βελτιώνει κυρίως τα συμπτώματα στις –off περιόδους του ασθενή, και επιτρέπει μείωση της δοσολογίας των αντιπαρκινσονικών φαρμάκων που απαιτούνται. Ο υποθαλάμιος πυρήνας θεωρείται σήμερα ο πιο αποτελεσματικός εγχειρητικός στόχος γιατί βελτιώνει όλα τα συμπτώματα της νόσου (τρόμου, δυσκαμψίας, βραδυκινησίας).
Αρχική εμπειρία στο Πανεπιστημιακό Νοσοκομείο Πατρών
Κατά το πρώτο έτος λειτουργίας του τμήματος Λειτουργικής Νευροχειρουργικής του Πανεπιστημιακού Νοσοκομείου Πατρών εξετάστηκαν σαν υποψήφιοι για χειρουργική επέμβαση 14 ασθενείς με ν. Πάρκινσον και 4 ασθενείς με δυστονία. Το προεγχειρητικό πρωτόκολλο περιελάμβανε νευροφυσιολογικό έλεγχο, μαγνητική τομογραφία εγκεφάλου, L-dopa test, UPDRS σε on και off κατάσταση, ψυχιατρική εκτίμηση, και τέστ γνωστικών λειτουργιών. Δέκα ασθενείς με ν. Πάρκινσον κρίθηκαν ακατάλληλοι για την χειρουργική θεραπεία για διάφορους λόγους. Τελικά χειρουργήθηκαν από τον συγγραφέα 4 ασθενείς με νόσο Πάρκινσον και 2 ασθενείς με δυστονία. Το εγχειρητικό πρωτόκολλο που ακολουθήσαμε περιελάμβανε : τοποθέτηση στερεοτακτικού πλαισίου (Radionics) (photo 2), εντοπισμός του στόχου-πυρήνα στον μαγνητικό τομογράφο του νοσοκομείου μας, επιβεβαίωση του στόχου με άτλαντα και σύστημα νευροπλοήγησης (Stealthstation) (Photo 3), διεγχειρητική χαρτογράφηση με μικροηλεκτρόδια και computer, έλεγχος διεγχειρητικός αποτελεσματικότητας ηλεκτρικής διέγερσης και παρενεργειών και εμφύτευση ηλεκτροδίου (DBS). Οι τρείς από τους τέσσερεις
ασθενείς με ν. Πάρκινσον παρουσίαζαν σοβαρές on-off διαταραχές, τρόμο, βαρειά δυσκαμψία σε – off κατάσταση, υπερκινησίες σε –on κατάσταση και είχαν εξαντληθεί τα περιθώρια φαρμακευτικής παρέμβασης. Ο τέταρτος ασθενής παρουσίαζε τρόμο ανθεκτικό σε κάθε φαρμακευτική παρέμβαση. Τα δεδομένα των ασθενών και τα αποτελέσματα περιγράφονται στον πίνακα 4.
Όλοι οι ασθενείς ανέχθηκαν την επέμβαση χωρίς προβλήματα και δεν υπήρχαν επιπλοκές ή παρενέργειες μετεγχειρητικά. Ο προγραμματισμός της λειτουργίας των ηλεκτροδίων έγινε μετά την 7η μετεγχειρητική ημέρα και τα αποτελέσματα της βελτίωσης των συμπτωμάτων των ασθενών ήταν άμεσα. Την ίδια ημέρα οι ασθενείς υποβάλλονται σε μαγνητική τομογραφία εγκεφάλου για επανέλεγχο της ακριβούς θέσης των ηλεκτροδίων στον προεπιλεγμένο πυρήνα-στόχο του εγκεφάλου (Photo 5). Όλοι οι ασθενείς και το άμεσο συγγενικό τους περιβάλλον χαρακτήρισαν σαν απόλυτα βελτιωμένη την κατάσταση των ασθενών μετεγχειρητικά ( οι τρείς ασθενείς με βαρειά ν. Πάρκινσον έχρηζαν βοηθείας από το συγγενικό τους περιβάλλον πολλές φορές κατά την διάρκεια της ημέρας προεγχειρητικά, ενώ ήταν απόλυτα ανεξάρτητοι μετεγχειρητικά). Οι ασθενείς συνεχίζουν να παρακολουθούνται σε τακτική βάση από τον θεράποντα νευρολόγο τους, ενώ ανά 6 μήνες χρήζουν επανεξέτασης από τον νευροχειρουργό.
REFERENCES
1.World Health Organization. www.who.int
2.National Institute of Neurological Disorders and Stroke. www.ninds.ninds.nih.gov
3.Speelman JD, Bosch DA. Resurgence of functional neurosurgery for Parkinson’s disease: a historical perspective. Mov Disord 1998;13:582-88
4.Bucy P, Buchanan DN. Athetosis. Brain 1932;55:479-92
5.Meyers R. Surgical experiments in the therapy of certain extrapyramidal diseases : a current evaluation. Acta Psychiatr Neurol 1951;67:1-42
6.Guridi J, Lozano AM. A brief history of pallidotomy. Neurosurgery 1997;41:1169-80
7.Hassler R, Riechert T. Indicationen and lokalosations method der gezielten Hirnoperationen. Nervearzt 1954; 25:441-47
8.Spiegel E.A, Wysic H.T. Stereoencephalotomy. Part II. Clinical and physiological applications. Grune & Stratton, New York, 1962.
9.Selby G. Stereotactic surgery for the relief of Parkinson’s disease. An analysis of the results in a series of 303 patients (413 operations). J Neurol Sci 1967;5:343-75
10.Laitinen L.V. Leksell’s unpublished pallidotomies of 1958-1962. Stereot Funct Neurosurg 2000;74:1-10
11.Albe-Fessard D, Arfel G, Guiot G. Activities caracteristoques du auelques structures cerebrales chez l’homme. Ann Chirurgie 1963;17:1185-1214
12.Laitinen L.V, Bergenheim A.T, Hariz M.I. Leksell’s posteroventral pallidotomy in the treatment of Parkinson’s disease. J Neurosurg 1992;76:53-61
13.Favre J, Taha J.M, Nguyen T.T et al. Pallidotomy: a survey of current practice in North America. Neurosurgery 1996;39:883-90
14.Payne B.R, Bakay R.A, Vitek J.K. Pallidotomy for treatment of Parkinson’s disease. In : Surgery for parkinson’s disease and movement disorders (Krauss J.K, Jankovic J, Grossman R.G , eds), Lippincott, Williams and Wilkins, Philadelphia, PA, pp.161-69
15.Jankovic J, Cardoso F, Grossman R.G, et al. Outcome after stereotactic thalamotomy for parkinsonian, essential and other types of tremor. Neurosurgery 1995;37:680-87
16.Bergman H, Wichmann T, DeLong M.R. Reversal of experimental parkinsonism by lesions of the subthalamic nucleus. Science 1990;249:1436-38
17.Mundinger F. New stereotactic treatment of spasmodic torticollis with a brain stimulation system. Med Klin 1977;72:1982-86
18.Benabid A.L, Pollak P, Gervason C, et al. Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus. Lancet 1991;337:403-06
19.Limousin P, Pollak P, Bennazzouz A, et al. Effect of parkinsonian signs and symptoms of bilateral subthalamic nucleus stimulation. Lancet 1995;345:91-95
20.Benazzouz A, Hallett M. Mechanism of action of deep brain stimulation. Neurology 2000;55(suppl.6):S17-20
21.Schuurman P.R, Bosch D.A, Bossuyt P.M, et al. A comparison of continuous thalamic stimulation and thalamotomy for suppression of severe tremor. N Engl J Med 2000;342:461-8
22.Hariz M.I. Complications of deep brain stimulation surgery.
Mov Disord. 2002;17 Suppl 3:S162-6.
23.Kumar R, Lang A.E. Patient selection for movement disorders surgery. In: Surgical treatment of Parkinson’s disease (Tarsy D, Vitek JL, Lozano AM, eds), Humana Press, Totowa, NJ, pp.53-67
24.Limousin P, Krack P, Pollack P, et al. Electrical stimulation of the subthalamic nucleus in Parkinson’s disease. N Engl J Med 1998;339:1105-11
25.Kumar R, Lozano A.M, Kim Y.J, et al. Double blind evaluation of subthalamic nucleus deep brain stimulation in advanced Parkinson’s disease. Neurology 1998;51:850-55
26.Krack P, Batir A, Van Blercom N, et al. Five year follow up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med 2003;349:1925-34
27.Burciel K.J, Anderson V.C, Favre J, et al. Comparison of pallidal and subthalamic nucleus deep brain stimulation for advanced Parkinson’s disease : results of a randomized, blinded study. Neurosurgery 1999;45:1375-82
28.Eidelberg D, Moeller J.R, Ishikawa T, et al. Regional metabolic correlates of surgical outcome following unilateral pallidotomy for Parkinson’s disease. Ann Neurol 1996;39:450-9
29. Alkhani A, Lozano A.M. Pallidotomy for Parkinson’s disease, a review of the literature. J Neurosurg 2001;94:43-49
30.Volkmann J, Sturm V, Weiss P, et al. Bilateral high frequency stimulation of the internal globus pallidus in advanced Parkinson’s disease. Ann Neurol 1998;44:953-61
31.Merello M, Nouzeilles M, Kuzis G, et al. Unilateral radiofrequency lesion versus electrostimulation of posteroventral pallidum: a prospective randomized comparison. Mov Disord 1999;14:50-56
32.Fox M, Ahlskog E.J, Kelly P.G. Stereotactic ventrolateralis thalamotomy mor medically intractable tremor in post levodopa era Parkinson’s disease patients. J Neurosurg 1991;75:723-30
33.Benabid A.L, Benazzouz A, Foffmann D, et al. Long term electrical inhibition of deep brain targets in movement disorders. Mov Disord 1998;13(suppl. 3):119-125
Εικόνα 1. Ο εμφυτευμένος βηματοδότης με το ηλεκτρόδιο στον εγκέφαλο.
Εικόνα 2. Το στερεοτακτικό σύστημα CRW που χρησιμοποιούμε.
Εικόνα 3. Το σύστημα νευροπλοήγησης Stealth Station που βοηθά στη ακριβή εντόπιση του στόχου – πυρήνα πριν την επέμβαση.