ΝΟΣΟΣ WILSON-ΗΠΑΤΟΦΑΚΟΕΙΔΗΣ ΕΚΦΥΛΙΣΗ
(WILSON DISEASE-ATP7B)
H ηπατοφακοειδής εκφύλιση ή νόσος του Wilson (WND-ATP7B) είναι μια κληρονομική νόσος που μεταβιβάζεται με υπολειπόμενο σωματικό χαρακτήρα και οφείλεται στη μείωση της απέκκρισης χαλκού από τα ηπατικά κύτταρα καθώς και τη μειωμένη ενσωμάτωση του στη σερουλοπλασμίνη. Aυτό έχει ως συνέπεια την αύξηση των επιπέδων του χαλκού και την συσσώρευση του στον ηπατικό ιστό, και στη συνέχεια στον εγκέφαλο, νεφρό και κερατοειδή χιτώνα. Η νόσος περιγράφηκε για πρώτη φορά το 1912.
Η συχνότητα της νόσου παγκοσμίως εκτιμάται ότι είναι από 1 στις 35000 έως 1 στις 100000 γεννήσεις ζώντων νεογνών και συχνότητα φορέων 1 στους 90. Η συχνότητα φορέων στη χώρα μας υπολογίζεται στο 1.2% και αναμένεται κάθε χρόνο η γέννηση 1 έως 3 νέων ασθενών. Σε κλειστές κοινωνίες όπως αυτή της Σαρδηνίας η συχνότητα της νόσου παρουσιάζεται σημαντικά αυξημένη.
H κλινική εικόνα οφείλεται στη τοξικότητα του χαλκού που προκαλεί βλάβη του ήπατος κατά τα πρώτα στάδια της νόσου και νευρολογική συμπτωματολογία στα προχωρημένα στάδια. H ηλικία έναρξης των συμπτωμάτων κυμαίνεται από 8-50 χρόνων. Χωρίς θεραπεία ο θάνατος επέρχεται 1-3 χρόνια μετά την έναρξη των νευρολογικών συμπτωμάτων και συνήθως είναι αποτέλεσμα ηπατικής ανεπάρκειας. Σε μεγάλο αριθμό περιπτώσεων ιδιαιτέρως σε μικρά παιδιά, τα αρχικά συμπτώματα από την προοδευτική συσσώρευση του χαλκού στο ήπαρ, μπορεί να είναι ο ίκτερος, ο ασκίτης ή η πυλαία υπέρταση και η νόσος μπορεί να εκλάβει μία ταχεία θανατηφόρο πορεία.
H διάγνωση της νόσου βασίζεται σε δύο τουλάχιστον από τα ακόλουθα σημεία:
α) χαμηλό επίπεδο σερουλοπλασμίνης (<20mg), μίας α2-σφαιρίνης γλυκοπρωτεϊνικής σύνθεσης, η οποία φυσιολογικά δεσμεύει το 90% του χαλκού στο πλάσμα και το αποδίδει σε ένζυμα που περιέχουν χαλκό. β) αυξημένη συγκέντρωση χαλκού στο ήπαρ (>250mg/g), που μπορεί να προσδιορισθεί σε παρασκεύασμα βιοψίας ήπατος.
γ) αυξημένη απέκκριση χαλκού απο τα ούρα (>100mg/24hr)
δ) παρουσία του δακτυλίου Kayser-Fleischer, ο οποίος προκαλείται απο τη συσσώρευση χαλκού στην περιφέρεια του κερατοειδούς και γίνεται ορατός κατά την εξέταση με σχισμοειδή λυχνία.
Όλοι οι ασθενείς με νόσο Wilson ασυμπτωματικοί ή μη χρειάζονται θεραπεία. Σκοπός της θεραπείας είναι αρχικά να αφαιρεθούν οι τοξικές ποσότητες χαλκού και μετέπειτα να προληφθεί η άθροισή του στους ιστούς. H νόσος είναι θανατηφόρος χωρίς θεραπεία αλλά αν διαγνωστεί έγκαιρα, θεωρείται ότι σε μεγάλο ποσοστό οι βλάβες είναι αναστρέψιμες ή μπορούν να προληφθούν σε προσυμπτωματικούς ασθενείς. H εξελικτική πορεία της νόσου προλαμβάνεται με χορήγηση παραγόντων που δεσμεύουν χαλκό, όπως είναι η πενικιλλαμίνη και η τριεντίνη. H διάγνωση της νόσου είναι εφικτή σε ασυμπτωματικούς ασθενείς οι οποίοι έχουν στενούς συγγενείς με την νόσο. O εντοπισμός των φορέων δεν είναι δυνατός με βιοχημικές μεθόδους αλλά μόνο με ανάλυση DNA του υπεύθυνου γονιδίου.
Η μεταμόσχευση ήπατος χρησιμοποιείται σε ασθενείς με πολύ προχωρημένη ηπατική νόσο, η οποία είναι μη αναστρέψιμος, καθώς και σε κεραυνοβόλες μορφές ηπατικής νόσου.
Μοριακή διαταραχή της νόσου
Η μελέτη της μοριακής διαταραχής της νόσου αποτελεί μία σημαντική συνεισφορά στην έγκαιρη και ακριβή διάγνωση, με αποτέλεσμα την άμεση ακόμα και προσυμπτωματική- με τεράστια οφέλη για τους ασθενείς- έναρξη της θεραπείας.
Η χαρτογράφηση του γονιδίου άρχισε το 1985 με μελέτες ανάλυσης γενετικής σύνδεσης. Το υπεύθυνο για τη νόσο γονίδιο εντοπίσθηκε στο χρωμόσωμα 13 σε στενή σύνδεση με το γονίδιο του ερυθροκυτταρικού ενζύμου εστεράσης-D. Πιο συγκεκριμένα στο μακρύ σκέλος του χρωμοσώματος 13, στην περιοχή 13q14-q21. Μερικά χρόνια αργότερα έγινε η απομόνωση και κλωνοποίηση του γονιδίου και ο ακριβής χαρακτηρισμός του. Tο γονίδιο έχει μέγεθος 80-100kb, αποτελείται από 21 εξόνια. To προϊόν της μεταγραφής του είναι 7.5Kb, και εκφράζεται ως επί το πλείστον στο ήπαρ και στον εγκέφαλο, σε μικρότερο βαθμό στο νεφρικό, καρδιακό και μυϊκό ιστό.
Η πρωτεΐνη που κωδικοποιείται από το γονίδιο αποτελείται απο 1466αα, έχει μέγεθος 160Kda, είναι μία αδενοσινοτριφωσφατάση τύπου Ρ με 54% των αμινοξέων της κοινά με την πρωτεΐνη της νόσου Menkes και εντοπίζεται στο Trans Golgi Network (σωματίδιο Golgi), όπου γίνεται και η ενσωμάτωση του χαλκού σε ένζυμα που χρειάζονται χαλκό για την λειτουργία τους. Tελευταίες μελέτες εντόπισαν ένα μικρότερο σε μέγεθος προϊόν της πρωτεΐνης στα μιτοχόνδρια. Tο προϊόν αυτό έχει μέγεθος 140Kda και του λείπει ένα μέρος του 5’ αμινoτελικού άκρου όπου υπάρχουν οι περιοχές δέσμευσης χαλκού. Πολλά οπό τα ένζυμα στα μιτοχόνδρια χρειάζονται χαλκό για την λειτουργία τους με αποτέλεσμα τα μιτοχόνδρια των ασθενών με τη νόσο να παρουσιάζουν αρκετές μορφολογικές αλλοιώσεις. H ελαττωματική ή η μη έκφραση της πρωτεΐνης στο ήπαρ εμποδίζει την μεταφορά του χαλκού από τα ηπατικά κύτταρα καθώς επίσης και τη δέσμευση του χαλκού από την αποσερουλοπλασμίνη για τη δημιουργία της σερουλοπλασμίνης. Kάτω από φυσιολογικές συνθήκες, αύξηση των επιπέδων του χαλκού στο κύτταρο πιστεύεται ότι προκαλεί την σύνθεση σερουλοπλασμίνης και συγχρόνως δέσμευση χαλκού από την ATP7B πρωτεΐνη και μετακίνηση της προς τη μεμβράνη του κυττάρου, για την απόδοση του χαλκού.
Περισσότερες από 200 μεταλλάξεις υπεύθυνες για τη νόσο έχουν ανιχνευθεί μέχρι σήμερα. Αρκετές από τις μεταλλάξεις εμφανίζονται σε μερικούς μόνο ασθενείς και είναι σαφής η εθνική κατανομή τους (συγκεκριμένο είδος μεταλλάξεων σε διαφορετικές πληθυσμιακές ομάδες). Η πιο συχνή μετάλλαξη παγκοσμίως είναι η H1069Q με συχνότητα έως και 65% στην κεντρική Ευρώπη και 10-35% σε Μεσογειακές χώρες.
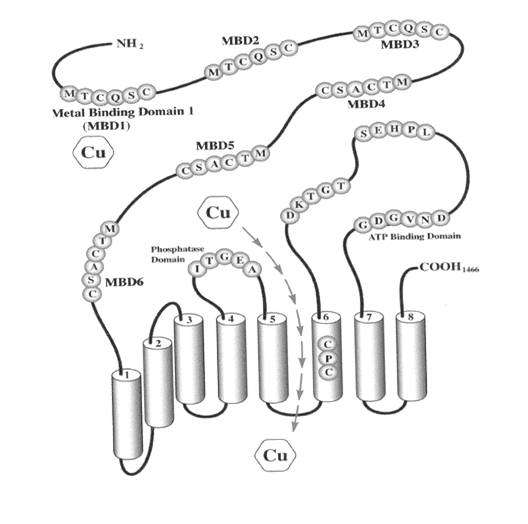
ΑΤΡ7Β Πρωτεΐνη
Μοριακή μελέτη στον Ελληνικό πληθυσμό
Το εργαστήριο Ιατρικής Γενετικής αποτελεί κέντρο αναφοράς για τη μελέτη ασθενών με τη νόσο Wilson η οποία ξεκίνησε το 1997. Το DNA απομονώνεται από λευκοκύτταρα περιφερικού αίματος και η μοριακή ανάλυση γίνεται με δύο τρόπους, έμμεσο και άμεσο. Έχουν μελετηθεί μέχρι σήμερα 93 ασθενείς από 69 συνολικά οικογένειες (συμπεριλαμβανομένων και 7 οικογενειών από την Κάλυμνο) και 163 φυσιολογικά άτομα για τον καθορισμό της συχνότητας των ετεροζυγωτών στον Ελληνικό πληθυσμό.
O έμμεσος τρόπος μοριακής ανάλυσης χρησιμοποιείται όταν δεν είναι γνωστή η μοριακή διαταραχή που προκαλεί τη νόσο και περιλαμβάνει την ανάλυση των απλοτύπων των μικροδορυφορικών επαναλαμβανόμενων αλληλουχιών που βρίσκονται στενά συνδεδεμένοι με το γονίδιο ATP7B.
Αποτελέσματα της μελέτης (Σχήμα 1)
• 20 μεταλλάξεις βρέθηκαν υπεύθυνες για το 86% των χρωμοσωμάτων WND στον Ελληνικό πληθυσμό.
• Οι 6 πιο συχνές μεταλλάξεις- p.H1069Q, p.R969Q, c.2530delA, p.L936X, p.Q289X and p.I1148T- βρέθηκαν στα εξόνια 14, 13, 10, 12, 2 και 16 και αποτελούν το 70% των χρωμοσωμάτων WND.
• 81% των μεταλλάξεων βρίσκονται συγκεντρωμένες σε 8 εξόνια του γονιδίου.
• 30 ασθενείς βρέθηκαν ομοζυγώτες για 9 μεταλλάξεις εκ των οποίων:
• 20 ασθενείς ήταν ομοζυγώτες για τις δύο πιο κοινές μεταλλάξεις – 13 για την p.H1069Q, και 7 για την p.R969Q
• 4 άλλες κοινές μεταλλάξεις (c.2530delA, p.L936X, p.Q289X and p.I1148T) βρέθηκαν σε ομοζυγωτία σε 2 ασθενείς η κάθε μία και για τις τρεις λιγότερο συχνές μεταλλάξεις- c.845delT, c.2299insC και c.1708-1G>A βρέθηκε 1 ομοζυγώτης ασθενής για την κάθε μία.
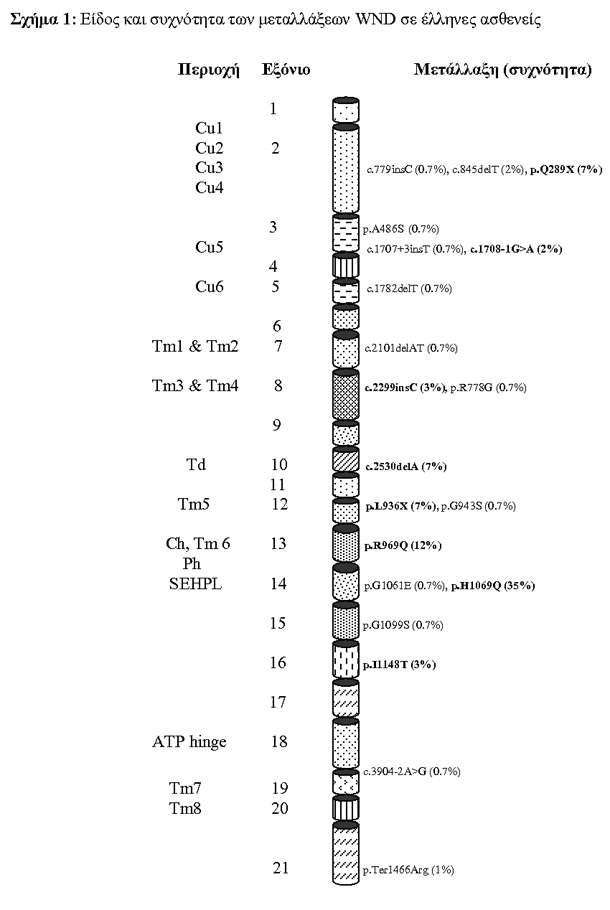
H ανίχνευση των κοινών μεταλλάξεων σε συνδυασμό με τα μικροδορυφορικά πολυμορφικά σημεία επιτρέπουν σε όλες τις οικογένειες:
α) Tην προσυμπτωματική διάγνωση ασθενών και την έναρξη θεραπευτικής αγωγής πριν την εκδήλωση κλινικών συμπτωμάτων.
β) την ταυτοποίηση φορέων στους συγγενείς των οικογενειών με τη νόσο (cascade screening) και την εφαρμογή διάγνωσης φορέων στα ζευγάρια πριν την τεκνοποίηση.
Από τη μελέτη των 163 φυσιολογικών ατόμων του γενικού πληθυσμού βρέθηκαν 2 ετεροζυγώτες για τη κοινή μετάλλαξη της νόσου, την H1060Q (1.2%), και τρεις ετεροζυγώτες για τρεις δυσερμηνεύσημες μεταλλάξεις: H1034R 1/163 [0.6%], E1093G* 1/163 [0.6%], S1310R (3930C>A) 1/163 [0.6%], οι οποίες δεν βρέθηκαν σε ασθενείς και πιθανολογείται να είναι πολυμορφισμοί. Επομένως η συχνότητα ετεροζυγωτών για τη νόσο ανέρχεται στο 1.2%.
Πηγή: http://iatriki-genetiki.med.uoa.gr