Τι είναι η Χρόνια Μυελογενής Λευχαιμία (ΧΜΛ);
Η χρόνια μυελογενής λευχαιμία (ΧΜΛ) είναι μία από τις τέσσερις πιο συνηθισμένες μορφές λευχαιμίας. Η παγκόσμια επίπτωση της ΧΜΛ είναι ένα ή δύο περιστατικά, ανά 100.000 άτομα το χρόνο, ενώ παράλληλα ευθύνεται για το 15% του συνόλου των περιστατικών λευχαιμίας στους ενήλικες. Η ΧΜΛ συνήθως εμφανίζεται στη μέση ηλικία – στα 45 με 55 έτη κατά μέσο όρο.1 Περίπου το 2% των περιστατικών που διαγιγνώσκονται με ΧΜΛ, είναι παιδιά.2 Στην Ελλάδα, υπολογίζεται ότι υπάρχουν περίπου 1200 ασθενείς με ΧΜΛ.
Η ΧΜΛ είναι μια αιματολογική κακοήθεια, στην οποία τα λευκά αιμοσφαίρια δεν ωριμάζουν, με αποτέλεσμα να πολλαπλασιάζονται σε μεγάλους αριθμούς. Χαρακτηρίζεται από την ύπαρξη μιας χρωμοσωμικής ανωμαλίας, γνωστής και ως χρωμόσωμα Φιλαδέλφειας (Ph). To χρωμόσωμα Ph δημιουργείται από την ανταλλαγή γενετικού υλικού μεταξύ των χρωμοσωμάτων 9 και 22. Ένα αποσπασμένο μέρος του χρωμοσώματος 22 μετατίθεται στο χρωμόσωμα 9 και ένα μέρος του χρωμοσώματος 9 μετατίθεται στο χρωμόσωμα 22, ένα φαινόμενο το οποίο ονομάζεται «αντιμετάθεση». Το βραχύ χρωμόσωμα 22 που προκύπτει ως αποτέλεσμα αυτού του φαινομένου, ονομάζεται χρωμόσωμα Φιλαδέλφειας.Το χρωμόσωμα αυτό εντοπίζεται σε όλους σχεδόν τους ασθενείς με ΧΜΛ (95%-100%) και οδηγεί στην παραγωγή μιας υβριδικής, παθολογικής κινάσης της τυσορίνης (ΤΚ), με αποτέλεσμα την υπερλειτουργία της. Αυτή η παθολογική κινάση της τυροσίνης ονομάζεται Bcr-Abl, χαρακτηρίζει τη ΧΜΛ και είναι μια εξειδικευμένη πρωτεΐνη, η οποία διαταράσσει τον φυσιολογικό ρυθμό παραγωγής των λευκών αιμοσφαιρίων και όχι μόνο.
Πρόσφατα δεδομένα αποδεικνύουν, ότι η θνησιμότητα της θετικής για το χρωμόσωμα Φιλαδέλφειας (Ph+) ΧΜΛ έχει μειωθεί ραγδαία μετά την εισαγωγή του imatinib το 2001. Στις ΗΠΑ, η Αμερικανική Αντικαρκινική Εταιρία εκτιμά ότι το 2006 διεγνώσθησαν 4.500 νέες περιπτώσεις ΧΜΛ, ενώ καταγράφηκαν 600 θάνατοι.3 Ο αριθμός αυτός αντιπροσωπεύει μείωση της θνησιμότητας κατά 75% από το 2001, όπου διεγνώσθησαν 4.600 νέα περιστατικά ΧΜΛ και καταγράφηκαν 2.400 θάνατοι.


Σχηματισμός του Χρωμοσώματος Ph
Διάγνωση και Στάδια της ΧΜΛ
Διάγνωση:
Η διάγνωση της ΧΜΛ γίνεται με τους ακόλουθους τρόπους:
1) Με εξέταση του καρυοτύπου στο μυελό των οστών
2) Με μία τεχνική που ονομάζεται FISH, που γίνεται στο μυελό των οστών ή στο περιφερικό αίμα και
3) Με μία ακόμα πιο εξειδικευμένη μοριακή τεχνική που ονομάζεται RT-PCR, που γίνεται επίσης είτε στο μυελό των οστών είτε στο περιφερικό αίμα.
Στάδια:
Μετά τη διάγνωση της ΧΜΛ, ο περαιτέρω έλεγχος καθορίζει το στάδιο ή την έκταση της νόσου και βοηθά στην ανάπτυξη του σχεδίου θεραπείας. Τα στάδια της ΧΜΛ περιλαμβάνουν:
Χρόνια Φάση:
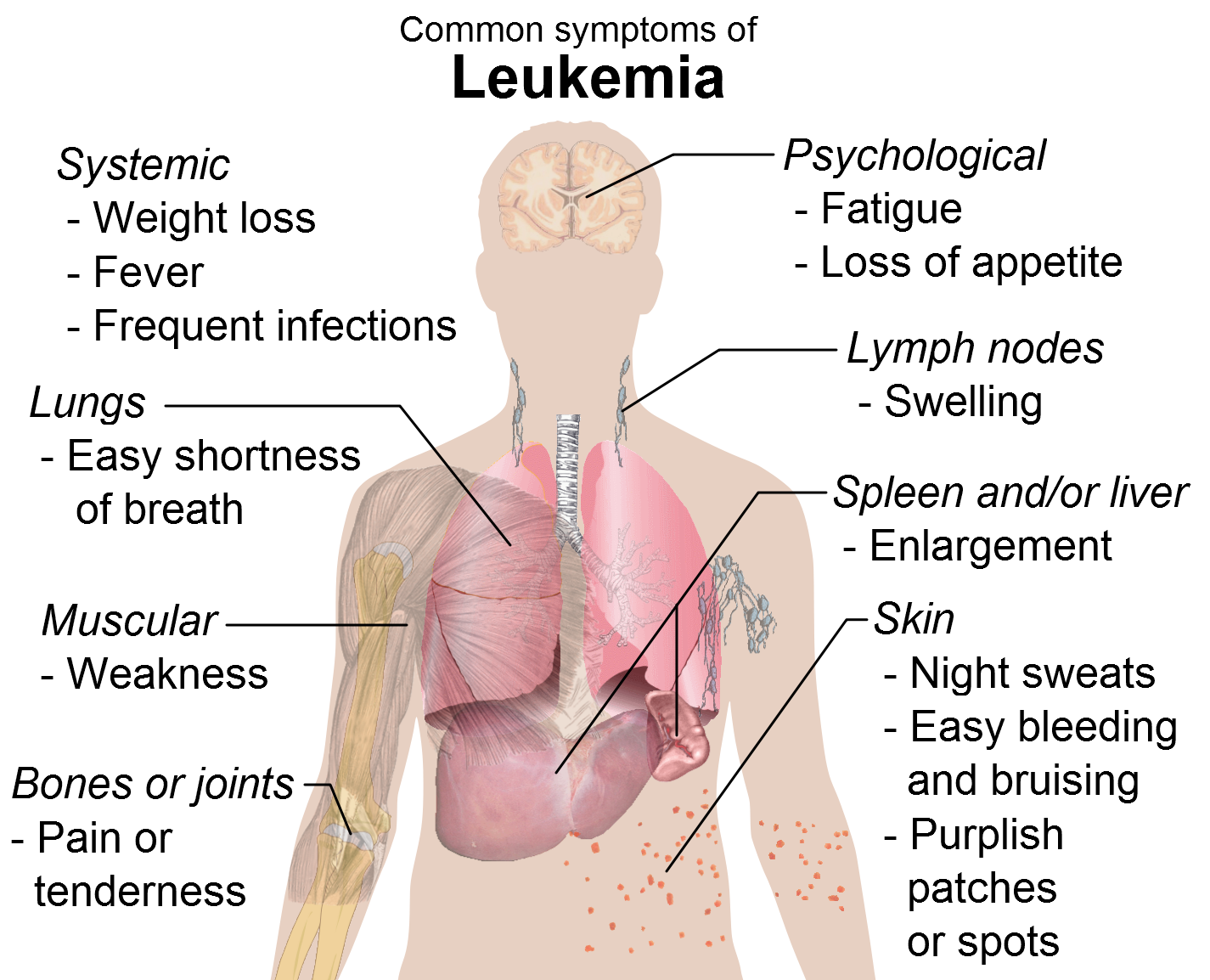
Κατά το αρχικό στάδιο της νόσου υπάρχουν λίγα άωρα κύτταρα (βλάστες) στο περιφερικό αίμα και στο μυελό των οστών, ενώ τα συμπτώματα μπορεί να είναι ή να μην είναι εμφανή. Το στάδιο αυτό μπορεί να διαρκέσει από μερικούς μήνες έως και μερικά χρόνια. Η πλειοψηφία των ασθενών απευθύνονται στον ιατρό τους ευρισκόμενοι σε αυτό το στάδιο, ενώ τα συμπτώματα που συνήθως συνοδεύουν τον ασθενή είναι εμμένουσα κόπωση, απώλεια ενέργειας, πυρετός, απώλεια όρεξης, εφίδρωση κατά την διάρκεια της νύκτας ή διόγκωση του σπλήνα. Χωρίς θεραπευτική αντιμετώπιση της νόσου σε αυτό το στάδιο, η νόσος εκτρέπεται γρήγορα σε επόμενη φάση, την επιταχυνόμενη ή ακόμα και τη βλαστική.
Επιταχυνόμενη Φάση:
Περισσότεροι βλάστες βρίσκονται στο αίμα και το μυελό των οστών, ενώ τα φυσιολογικά κύτταρα είναι λιγότερα. Συχνά τα συμπτώματα είναι εμφανή, κυρίως αναιμία και σπληνομεγαλία.
Βλαστική Φάση:
Αριθμός βλαστών μεγαλύτερος από 30% των φυσιολογικών ανευρίσκεται στο αίμα ή στον μυελό των οστών, οι οποίοι μπορεί να σχηματίσουν όγκους εκτός μυελού των οστών. Αναφέρεται και ως «βλαστική κρίση», μια κατάσταση κατά την οποία ο αυξημένος αριθμός βλαστών προκαλεί απειλητικές για τη ζωή λοιμώξεις, σοβαρή αναιμία, αιμορραγικές εκδηλώσεις και τελικά τον θάνατο του ασθενούς.
Θεραπεία και Ανταπόκριση
Ο κύριος στόχος της θεραπείας: Η εξάλειψη του Χρωμοσώματος Ph
Ο έλεγχος των σημείων και των συμπτωμάτων της ΧΜΛ, η μείωση του αριθμού των λευκών αιμοσφαιρίων και η πρόληψη της εξέλιξης της ΧΜΛ προς τις τελικές φάσεις της νόσου, είναι πολύ σημαντικοί στόχοι της θεραπείας. Καθώς η ΧΜΛ προκαλείται από μια συγκεκριμένη γενετική ανωμαλία, η εξάλειψη του χρωμοσώματος Ph αποτελεί τον κύριο σκοπό της θεραπείας.
Η επιτυχής θεραπευτική αντιμετώπιση της ΧΜΛ συνοδεύεται από τη μείωση ή και εξάλειψη του παθολογικού χρωμοσώματος Φιλαδέλφεια στον καρυότυπο.
Η πλήρης εξάλειψη του χρωμοσώματος Ph από τον μυελό των οστών θεωρείται ως πλήρης κυτταρογενετική ανταπόκριση. Έχει φανεί ότι, για διάφορες θεραπείες της ΧΜΛ, υπάρχει άμεση συσχέτιση μεταξύ της κυτταρογενετικής ανταπόκρισης και της παράτασης της επιβίωσης.
Πριν την είσοδο στην κλινική πράξη του imatinib το 2001, η θεραπεία ήταν μάλλον παρηγορητική. Η ιντερφερόνη, μία μη ειδική θεραπεία, που οδήγησε σε εξάλειψη του χρωμοσώματος σε ένα μικρό ποσοστό των ασθενών, συνοδευόταν από αρκετές παρενέργειες και από δυσκολία στον τρόπο χορήγησης (καθημερινές υποδόριες ενέσεις). Η μεταμόσχευση μυελού των οστών, που μέχρι το 2001 θεωρείτο η μοναδική θεραπευτική επιλογή που οδηγεί σε ίαση τους ασθενείς με ΧΜΛ, έχει υψηλά ποσοστά θνητότητας και νοσηρότητας, ενώ πρέπει να έχει εξασφαλιστεί προηγουμένως η ύπαρξη κατάλληλου δότη. Επιπλέον η μεταμόσχευση δεν είναι δυνατή σε ασθενείς μεγάλης ηλικίας.
Το imatinib, μία από του στόματος θεραπεία, αποτέλεσε επανάσταση στη θεραπευτική αντιμετώπιση της νόσου όταν εισήχθη στην κλινική πράξη το 2001. Στοχεύοντας εκλεκτικά τα παθολογικά, Φιλαδέλφεια θετικά κύτταρα, το imatinib οδηγεί σε πολύ υψηλή αποτελεσματικότητα, διατηρώντας το 95% των ασθενών εν ζωή ύστερα από 5 χρόνια θεραπείας, εξασφαλίζοντας πολύ καλή ποιότητα ζωής με ελάχιστη εμφάνιση παρενεργειών.
Σύμφωνα με τις κατευθυντήριες γραμμές που εκδόθηκαν πρόσφατα από το Ευρωπαϊκό Δίκτυο για τη Λευχαιμία (ELN – European Leukemia Network), όλοι οι ασθενείς με ΧΜΛ πρέπει να αρχίζουν θεραπεία με imatinib στην ελάχιστη δόση των 400 mg ημερησίως με δυνατότητα κλιμάκωσης της δόσης σε 600 – 800 mg ημερησίως υπό συγκεκριμένες προϋποθέσεις μη ικανοποιητικής ανταπόκρισης.
Στις περιπτώσεις εκείνες που δεν επιτυγχάνεται η επιθυμητή ανταπόκριση ακόμα και σε μεγαλύτερες δόσεις του imatinib ή εμφανίζονται σημαντικές παρενέργειες υπό imatinib, είναι διαθέσιμοι 2ης γενιάς αναστολείς τυροσινικής κινάσης της Bcr-Abl. Το dasatinib είναι ένας τέτοιος αναστολές 2ης γενιάς που κυκλοφορεί από το 2007.
Πρόσφατα κυκλοφόρησε και στην Ελλάδα το nilotinib, ένας ακόμα πιο εκλεκτικός αναστολέας τυροσινικής κινάσης της Bcr-Abl. Η αποτελεσματικότητα του nilotinib, που στοχεύει ακόμα πιο ισχυρά και εκλεκτικά την Bcr-Abl, την καθοριστική δηλαδή παθογενετική βλάβη της ΧΜΛ, επιβεβαιώνεται από τα αποτελέσματα κλινικών μελετών σε ασθενείς με ΧΜΛ, που είχαν προηγουμένως αναπτύξει αντίσταση ή παρενέργειες στο imatinib.
Το nilotinib, χορηγούμενο από του στόματος δις ημερησίως, όπως έδειξαν οι κλινικές μελέτες, προσφέρει υψηλή, άμεση και με διάρκεια ανταπόκριση στους ασθενείς εκείνους που δεν ανταποκρίνονται ή που δεν μπορούν να λάβουν το imatinib λόγω παρενεργειών. Η μεγάλη πλειοψηφία των ασθενών σε αρχικά στάδια της νόσου πέτυχε Πλήρη Αιματολογική Ανταπόκριση (δηλ. ομαλοποίηση της γενικής αίματος), ενώ το 57% και 41% των ασθενών πέτυχαν Μέγιστη και Πλήρη Κυτταρογενετική Ανταπόκριση αντίστοιχα (δηλαδή σημαντική μείωση ή και εξάλειψη του χρωμοσώματος Φιλαδέλφεια στο μυελό των οστών).
H κυτταρογενετική ανταπόκριση, δηλ. η μείωση του αριθμού των κυττάρων Ph+ τα οποία ανιχνεύονται με μία εξέταση που ονομάζεται καρυότυπος μυελού των οστών, θεωρείται παραδοσιακά ως ένδειξη αποτελεσματικότητας μιας συγκεκριμένης θεραπείας.
Επίσης πολύ σημαντικό είναι το γεγονός ότι το nilotinib επιδεικνύει εξαιρετικό προφίλ ασφάλειας, εξασφαλίζοντας μία πολύ καλή ποιότητα ζωής στους ασθενείς αφού η εμφάνιση παρενεργειών δεν είναι συχνή.
Η αποτελεσματικότητα της θεραπείας της ΧΜΛ αξιολογείται βάσει δυο καθιερωμένων κριτηρίων: την αιματολογική και την κυτταρογενετική ανταπόκριση.
Αιματολογική Ανταπόκριση
Η πλήρης αιματολογική ανταπόκριση ορίζεται ως η ομαλοποίηση της γενικής αίματος, που διαρκεί τουλάχιστον τέσσερις εβδομάδες, και η οποία ουσιαστικά αναγνωρίζει το βαθμό στον οποίο η πιο εμφανής παθολογική κατάσταση της ΧΜΛ έχει ρυθμιστεί (δηλ. ο αυξημένος αριθμός των λευκών αιμοσφαιρίων). Κατά τη διάρκεια της αιματολογικής ανταπόκρισης, τα κύτταρα θετικά για το χρωμόσωμα Ph (Ph+) μπορεί να είναι ακόμα ανιχνεύσιμα.
Κυτταρογενετική Ανταπόκριση
H κυτταρογενετική ανταπόκριση, η οποία παραδοσιακά θεωρείται από τους ερευνητές ως ένδειξη ότι μια συγκεκριμένη θεραπεία είναι αποτελεσματική, είναι η μείωση του αριθμού των κυττάρων Ph+, τα οποία ανιχνεύονται με μια εξέταση που λέγεται έλεγχος καρυοτύπου μυελού των οστών. Αυτή αποτελεί μια ένδειξη του βαθμού στον οποίο η ίδια η καθοριστική παθογενετική βλάβη της νόσου έχει μειωθεί ή και εξαφανισθεί.
Μοριακή Ανταπόκριση
Είναι πιθανό να υπάρχουν αντίγραφα του υβριδικού γονιδίου Bcr-Abl ακόμα κι αν έχει επιτευχθεί πλήρης κυτταρογενετική ανταπόκριση. Ενώ η επίτευξη της κυτταρογενετικής ανταπόκρισης παραμένει σημαντική, πολλοί ερευνητές ισχυρίζονται ότι τα βέλτιστα αποτελέσματα εμφανίζονται όταν οι ασθενείς με ΧΜΛ επιδεικνύουν και ικανοποιητικήμοριακή ανταπόκριση. Ως ικανοποιητική μοριακή ανταπόκριση, θεωρείται η εξαφάνιση ή η μείωση των ποσοτήτων του γονιδίου Bcr-Abl, η οποία παράγει την παθολογική πρωτεΐνη που είναι υπεύθυνη για τον πολλαπλασιασμό των λευκών αιμοσφαιρίων στους ασθενείς με ΧΜΛ. Μια πλήρης μοριακή ανταπόκριση σημαίνει ότι τα επίπεδα του γονιδίου Bcr-Abl δεν είναι ανιχνεύσιμα και μπορεί να αποδειχθεί ως ένας νέος πιθανός δείκτης της αξιολόγησης της θεραπείας και της πρόγνωσης της νόσου.
Η μοριακή ανταπόκριση μπορεί να μετρηθεί με μια νέα σχετικά τεχνική, που ονομάζεται ποσοτική αλυσιδωτή αντίδραση της πολυμεράσης (Q-PCR), η οποία μετρά ακόμα και ελάχιστα επίπεδα αντιγράφων Bcr-Abl.
Βιβλιογραφία:
Faderl S; Talpaz M; Estrov Z; O’Brien S; Kurzrock R; Kantarjian HM. The biology of chronic myeloid leukemia. N Engl J Med 1999 Jul 15;341(3):164-72.
2 American Cancer Society. Overview: Leukemia – Chronic Myeloid (CML). . Last accessed Jan 22, 2007.
3 American Cancer Society.; Cancer Facts & Figures 2006
4 American Cancer Society.; Cancer Facts & Figures 2001
5 Druker et al. NEJM 2006;355:2408-17
6 Baccarani et al. Blood 2006;108(6):1809-20
7 Kantarjan et al. Oral presentation at ASH 2007. Blood 2007;110(11):abstract #735.
8 Cortes et al. ASH 2007. Blood 2007;110(11):abstract # 1040.
Πηγή: Ίδρυμα ελληνικής αιματολογικής εταιρείας