Νέα δεδομένα για την αντιμετώπιση του καρκίνου του θυρεοειδούς,
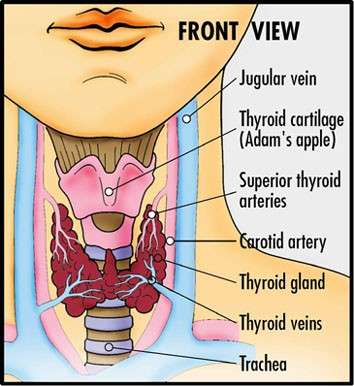
Νέα δεδομένα από το περιοδικό TheLancet. για την αντιμετώπιση του καρκίνου του θυρεοειδούς,
Τα θετικά αποτελέσματα της μελέτης DECISION, μίας μελέτης φάσης ΙΙΙ του Nexavar (sorafenib), δημοσιεύθηκαν στην διαδικτυακή έκδοση του περιοδικού The Lancet, στις 23 Απριλίου.
Σύμφωνα με τα αποτελέσματα της μελέτης αυτής, το sorafenib επέκτεινε σημαντικά το χρονικό διάστημα επιβίωσης χωρίς εξέλιξη της νόσου στους ασθενείς που το έλαβαν, σε σύγκριση με το εικονικό φάρμακο. Επίσης η μελέτη κατέδειξε μείωση κατά 41% του κινδύνου εξέλιξης ή θανάτου για τους ασθενείς που έλαβαν sorafenib σε σύγκριση με τους ασθενείς που έλαβαν εικονικό φάρμακο. Διερευνητική ανάλυση των υποομάδων της μελέτης, δηλαδή αναλύσεις που έγιναν με βάση την ηλικία, το φύλο, τη γεωγραφική περιοχή, την ιστολογία, τις εντοπίσεις των μεταστάσεων και το φορτίο του όγκου, έδειξαν ότι τα πολύ θετικά αποτελέσματα είναι σταθερά σε όλες τις υποομάδες των ασθενών. Μάλιστα, λόγω των πολύ καλών αποτελεσμάτων, το 71% των ασθενών που ελάμβαναν εικονικό φάρμακο και παρουσίασαν εξέλιξη της νόσου, μεταφέρθηκαν άμεσα κατά τη μελέτη στην ομάδα του sorafenib.
Ένα ακόμη πολύ θετικό μήνυμα από τη μελέτη είναι η σημαντική βελτίωση του ποσοστού ελέγχου της νόσου, καθώς και του χρόνου που μεσολαβεί μέχρι την εξέλιξη της σε ασθενείς που ελάμβαναν sorafenib έναντι του εικονικού φαρμάκου. Επιπροσθέτως, στην πλειονότητα των ασθενών που έλαβαν sorafenib παρατηρήθηκε συρρίκνωση των βλαβών. Οι ανεπιθύμητες ενέργειες ήταν σύμφωνες με το γνωστό προφίλ ασφάλειας του sorafenib, αφού το Nexavar κυκλοφορεί από το 2006 παγκοσμίως για την αντιμετώπιση άλλων τύπου καρκίνου. Οι πιο κοινές ΑΕ που αναφέρθηκαν από την ομάδα του sorafenib περιελάμβαναν δερματολογική αντίδραση χεριού-ποδιού, διάρροια, αλωπεκία, εξάνθημα / απολέπιση, κόπωση, απώλεια βάρους και υπέρταση.
Τα δεδομένα αυτά χρησιμοποιήθηκαν από την υπεύθυνη εταιρεία για το προϊόν, την Bayer, για την λήψη της έγκρισης από τον Αμερικανικό Οργανισμό Φαρμάκων και Τροφίμων (FDA) του sorafenib για τη θεραπεία ασθενών με υποτροπιάζοντα ή μεταστατικό, προοδευτικό, ανθεκτικό στο ραδιενεργό Ιώδιο, διαφοροποιημένο καρκίνο του θυρεοειδούς, τον Νοέμβριο του 2013. Έχει επίσης υποβληθεί ο φάκελος του sorafenib στον Ευρωπαϊκό Οργανισμό Φαρμάκων (ΕΜΑ) για επέκταση της άδειας κυκλοφορίας και στη συγκεκριμένη ένδειξη και η Ευρωπαϊκή Επιτροπή για Τα Φάρμακα Ανθρώπινης Χρήσης έχει ήδη προτείνει την έγκριση της ένδειξης αυτής. Αναμένεται η τελική απόφαση από τον ΕΜΑ, στα μέσα του 2014. Επίσης, τον Νοέμβριο του 2013, ο ΕΜΑ ενέκρινε το sorafenib ως ορφανό φάρμακο για τη θεραπεία του θυλακιώδους και θηλώδους καρκίνου του θυρεοειδούς.
Σύμφωνα με τον Δρ Martin Schlumberger του Ινστιτούτου Gustave-Roussy στη Γαλλία και ενός εκ των κύριων ερευνητών της μελέτης DECISION, «Η μελέτη DECISION αποτελεί την πρώτη μελέτη Φάσης III σε ασθενείς με ανθεκτικό στο ραδιενεργό Ιώδιο, διαφοροποιημένο καρκίνο του θυρεοειδούς και αυτά τα θετικά αποτελέσματα είναι προς όφελος των ασθενών που πάσχουν από αυτή τη νόσο και δεν έχουν επί του παρόντος μια συγκεκριμένη θεραπευτική επιλογή. Η δημοσίευση των αποτελεσμάτων αυτών στο περιοδικό The Lancet ενισχύει την αποτελεσματικότητα και την ασφάλεια του sorafenib που καταδείχθηκαν στη μελέτη DECISION, και που οδήγησαν στην έγκρισή του σκευάσματος στις ΗΠΑ και υποστηρίζουν την κατάθεση προς έγκριση στην ΕΕ ως μια πιθανή νέα θεραπευτική επιλογή για τους ασθενείς στην Ευρώπη».
Ο καρκίνος του θυρεοειδούς είναι η πιο συχνή ενδοκρινική κακοήθεια. Υπάρχουν περισσότερες από 298.000 νέες περιπτώσεις καρκίνου του θυρεοειδούς ετησίως και περίπου 40.000 άνθρωποι πεθαίνουν από καρκίνο του θυρεοειδούς σε όλο τον κόσμο κάθε χρόνο.
Θηλώδεις, θυλακιώδεις και ελάχιστα διαφοροποιημένες μορφές του καρκίνου ταξινομούνται συνολικά ως «διαφοροποιημένος καρκίνος του θυρεοειδούς» και αντιπροσωπεύουν περίπου το 94 % του συνόλου των περιπτώσεων καρκίνου του θυρεοειδούς. Ενώ η πλειοψηφία των διαφοροποιημένων καρκίνων του θυρεοειδούς είναι θεραπεύσιμη, η περίπτωση του ανθεκτικού στο ραδιενεργό Ιώδιο, είτε είναι τοπικά προχωρημένος, είτε είναι μεταστατικός, είναι πιο δύσκολο να θεραπευτεί και συνδέεται με χαμηλότερο ποσοστό επιβίωσης των ασθενών.
Το προϊόν Nexavar (sorafenib) κυκλοφορεί ήδη στην Ελλάδα από την εταιρεία Bayer για τη θεραπεία του καρκίνου του ήπατος (ηπατοκυτταρικό καρκίνωμα) και για τη θεραπεία του καρκίνου του νεφρού (προχωρημένο καρκίνωμα νεφρών) σε προχωρημένο στάδιο, όταν η συνήθης θεραπεία δε βοήθησε στο να σταματήσει η εξέλιξη της πάθησης ή θεωρείται ακατάλληλη.