Παθήσεις ωχράς κηλίδας και θεραπεία
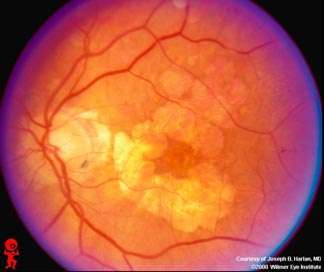
Οι παθήσεις της ωχράς είναι μεταξύ των κυριοτέρων αιτίων τύφλωσης ατόμων τρίτης ηλικίας στον δυτικό κόσμο. Στην χωρά μας, οι πάσχοντες (Ηλικιακή Εκφύλιση Ωχράς (ΗΕΩ), Διαβητικό Οίδημα της Ωχράς (ΔΟΩ)) ανέρχονται σε >50.000 ασθενείς.
Η ΗΕΩ ξεκινά με σημαντική απώλεια όρασης (μείωση οπτικής οξύτητας), παραμόρφωση αντικειμένων (μεταμορφωψίες) και μαύρη κηλίδα στο κέντρο της όρασης (κεντρικό σκότωμα).
Αν μείνει χωρίς θεραπεία, το 50% των ασθενών οδηγείται σε νομική τύφλωση σε 2 έτη. Tο δε ΔΟΩ ξεκινά με σταδιακή απώλεια όρασης (μείωση οπτικής οξύτητας) και μαύρες κηλίδες στο οπτικό πεδίο. Αν μείνει όμως χωρίς θεραπεία, οι ασθενείς οδηγούνται σε μόνιμη σοβαρή απώλεια όρασης ή και τύφλωση.
Υπάρχουν εγκεκριμένες αντιαγγειογεννετικές θεραπείες, που αν εφαρμοστούν εγκαίρως, και με το σωστό δοσολογικό σχήμα μπορούν να εμποδίσουν την απώλεια της όρασης και να επαναφέρουν μέρος της όρασης που έχει χαθεί. Πολύ σημαντικό για την βέλτιστη θεραπευτική ανταπόκριση των ασθενών και στις δυο αυτές παθήσεις είναι η έγκαιρη διάγνωση, η έγκαιρη θεραπεία των ασθενών, καθώς και ο τακτικός μηνιαίος επανέλεγχος και η υπνοθεραπεία.
Η ρανιμπιζουμάμπη (Ranibizumab, Lucentis) είναι η θεραπεία εκλογής στις παθήσεις αυτές, και αποτελεί το πλέον δοκιμασμένο και αποτελεσματικό σκεύασμα, με πάνω από 7 χρόνια κλινικής εμπειρίας. Πρόσφατες δημοσιεύσεις δείχνουν ότι με την έγκριση της ρανιμπιζουμάμπης η τυφλότητα από Ηλικιακή εκφύλιση ωχράς κηλίδας μειώθηκε στο 50%. Το Lucentis έχει σχεδιασθεί, αναπτυχθεί και παραχθεί ειδικά για ενδοϋαλώδη οφθαλμική χρήση και είναι το μόνο αντι-VEGF που έχει αδειοδοτηθεί για πέντε οφθαλμικές ενδείξεις. Είναι το μόνο αντι-VEGF που έχει αδειοδοτηθεί για πέντε οφθαλμικές ενδείξεις: την υγρή ηλικιοεξαρτώμενη εκφύλιση της ωχράς κηλίδας (ΗΕΩ), την διαταραχή της όρασης λόγω διαβητικού οιδήματος της ωχράς κηλίδας (ΔΟΩ), την διαταραχή της όρασης λόγω οιδήματος της ωχράς κηλίδας δευτεροπαθώς από φλεβική αμφιβληστροειδική απόφραξη (RVO), στην οποία περιλαμβάνεται τόσο η κλαδική RVO όσο και η κεντρική RVO, καθώς και την διαταραχή της όρασης λόγω νεοαγγείωσης του χοριοειδούς δευτεροπαθώς από παθολογική μυωπία. Το Lucentis διαθέτει καλά χαρακτηρισμένο προφίλ ασφάλειας με περισσότερα από 2,4 εκατομμύρια έτη έκθεσης ασθενών-θεραπείας σε παγκόσμιο επίπεδο, ενώ το προφίλ ασφάλειας του Lucentis παρακολουθείται συνεχώς ως προς όλες τις αδειοδοτημένες ενδείξεις του μέσω ενός οργανωμένου συστήματος φαρμακοεπαγρύπνησης.
Ωστόσο, με κυριότερο λόγο τις καθυστερήσεις στην έγκριση της θεραπείας από τον ΕΟΠΥΥ (προκειμένου οι ασθενείς να αποκτήσουν πρόσβαση στη θεραπεία τους, αναγκάζονται για κάθε χορήγηση να καταθέσουν το φάκελό τους στον ΕΟΠΥΥ και να περιμένουν την απάντηση από την επιτροπή ΦΥΚ του ΕΟΠΥΥ), αρκετοί ιατροί χρησιμοποιούν off-label την μπεβασιζουμάμπη (Bevacizumab, Avastin) ενδοφθαλμίως.
Η μπεβασιζουμάμπη είναι ένας αντι-αγγειογενετικός (Anti-VEFG) παράγοντας ο οποίος έχει αναπτυχθεί για την ενδοφλέβια χορήγηση για την αντιμετώπιση διαφόρων τύπων καρκίνου. Ενδεικτικό είναι ότι ο ίδιος ο Ευρωπαικός Οργανισμός Φαρμάκων τροποποίησε την περίληψη χαρακτηριστικών του προϊόντος Avastin, διευκρινίζοντας τα κάτωθι:
Στην παράγραφο την σχετική με «Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση», αναφέρεται ότι […] η σύνθεση του Avastin δεν ενδείκνυται για ενδοϋαλοειδική χρήση.
Επιπλέον στο φύλλο οδηγιών χρήσης, πληροφορίες για τον χρήστη ξεκαθαρίζεται ότι :
…Το Avastin έχει αναπτυχθεί και παρασκευαστεί για τη θεραπεία του καρκίνου με ένεση στην κυκλοφορία του αίματος. Δεν έχει αναπτυχθεί ή παρασκευαστεί για να ενίεται μέσα στο μάτι. Ως εκ τούτου, δεν επιτρέπεται να χορηγείται με αυτόν τον τρόπο.
Πριν από τον καθορισμό οποιουδήποτε φαρμάκου ως κατάλληλου για να αδειοδοτηθεί για δημόσια χρήση, το φάρμακο αξιολογείται από ρυθμιστικό σώμα που διενεργεί αξιολόγηση κινδύνου/οφέλους με βάση το προφίλ ασφάλειας, αποτελεσματικότητας και ποιότητας του φαρμάκου μετά από ένα αυστηρό πρόγραμμα κλινικών μελετών. Αυτή η αξιολόγηση δεν έχει διενεργηθεί για το μη αδειοδοτημένο για οφθαλμική χρήση Avastin. Επιπρόσθετα, ενώ οι οφθαλμίατροι έχουν τη δυνατότητα να αναφέρουν στο σύστημα φαρμακοεπαγρύπνησης τα ανεπιθύμητα συμβάντα που εκδηλώνονται μετά από ενδοϋαλώδη χορήγηση Avastin, η μη αδειοδοτημένη ενδοϋαλώδης χρήση Avastin δεν υποστηρίζεται από συγκεκριμένο εκπαιδευτικό υλικό που θα κατευθύνει τους επαγγελματίες υγείας και τους ασθενείς να αναφέρουν τα ανεπιθύμητα συμβάντα και θα παρέχει πληροφορίες σχετικά με την ασφαλή χρήση και κατανόηση του προϊόντος.
Ωστόσο, υπάρχει αυξανόμενο σώμα αποδεικτικών στοιχείων σύμφωνα με τα οποία η μη αδειοδοτημένη ενδοφθάλμια χρήση Avastin εκθέτει τους ασθενείς σε συστηματικούς (αγγειακό εγκεφαλικό επεισόδιο) και οφθαλμικούς κινδύνους ασφάλειας (όπως φλεγμονή ή επιπλοκές που είναι δυνατόν να προκαλέσουν σοβαρή διαταραχή της όρασης ή τύφλωση). Μάλιστα, τα δεδομένα από τη ανεξάρτητη μελέτη CATT (δύο ετών), την συγκεντρωτική CATT (ενός έτους) και την IVAN (ενός έτους) έδειξαν αυξημένο κίνδυνο εκδήλωσης σοβαρού ανεπιθύμητου συμβάντος με την μη αδειοδοτημένη ενδοφθάλμια χρήση του Avastin σε σύγκριση με το Lucentis, προσθέτοντας στο αυξανόμενο σώμα αποδεικτικών στοιχείων που υποδηλώνουν προβλήματα ασφάλειας σε σχέση με την μη αδειοδοτημένη ενδοϋαλώδη χρήση του Avastin. Ένα σημαντικό εύρημα είναι ότι η χορήγηση του Avastin στο εσωτερικό του οφθαλμού έχει ως αποτέλεσμα σημαντική μείωση των επιπέδων του αγγειακού ενδοθηλιακού αυξητικού παράγοντα (VEGF) που κυκλοφορεί στο αίμα, σε σύγκριση με το Lucentis. Αυτή η μείωση των επιπέδων του VEGF της κυκλοφορίας ενδέχεται να συνδέεται με αυξημένο κίνδυνο σοβαρών συστηματικών ανεπιθύμητων συμβάντων.
Η δε Γαλλική μελέτη GEFAL, όταν συνδυάστηκε σε μετα-ανάλυση ασφάλειας με τις IVAN, CATT και MANTA, έδειξε σημαντικά περισσότερα σοβαρά συστηματικά ανεπιθύμητα συμβάντα με την μη αδειοδοτημένη ενδοϋαλώδη χρήση του Avastin σε σύγκριση με το Lucentis εντός ενός έτους (αναλογία πιθανοτήτων 1.34, όριο αξιοπιστίας 95%, 1.08 έως 1.65).
Ακόμα όμως και στη διαδικασία παρασκευής τους, τα δυο αυτά διαφέρουν. Το Lucentis παράγεται με βάση τα υψηλότερα πρότυπα για ενδοφθάλμια (ενδοϋαλώδη) χρήση. Κάθε θεραπευτική δόση περιέχεται σε φιαλίδια που προορίζονται για εφάπαξ χρήση. Το Lucentis συμμορφώνεται με τις συγκεκριμένες απαιτήσεις της Φαρμακοποιίας για τα οφθαλμικά διαλύματα, οι οποίες είναι αυστηρότερες από εκείνες για τα παρεντερικά (δηλαδή ενδοφλέβια) προϊόντα. Τα δε φιαλίδια του Avastin, που προορίζονται για ενδοφλέβια χορήγηση σε ορισμένες μορφές καρκίνου, πληρούν τα πρότυπα παραγωγής για τις ενδοφλέβιες φαρμακοτεχνικές μορφές φαρμάκων, τα οποία επιτρέπουν υψηλότερη συγκέντρωση σωματιδίων σε σχέση με τις φαρμακοτεχνικές μορφές για οφθαλμική χρήση. Το Avastin δεν πληροί τα πρότυπα παραγωγής για ενδοφθάλμια (ενδοϋαλώδη) χρήση. Άλλωστε, η ανάλυση βάσης δεδομένων των Gower et al έδειξε υψηλότερο κίνδυνο οφθαλμικής φλεγμονής με το μη αδειοδοτημένο ενδοϋαλώδες Avastin σε σύγκριση με το Lucentis.
Τέλος, δυστυχώς, αρκετοί ασθενείς δεν ενημερώνονται καν για το ποιο σκεύασμα τους χορηγείται, καθώς ο ασθενής επιβάλλεται να ενημερώνεται για τις πιθανές επιπλοκές /κινδύνους και να συναινεί γραπτώς, κάνοντας χρήση του θεσμοθετημένου δικαιώματος των ασθενών να γνωρίζουν και να συναινούν ή να απορρίπτουν κάθε διαγνωστική ή θεραπευτική πράξη που πρόκειται να τους διενεργηθεί. (Νόμος 2071/1992 άρθρο 47 “Τα δικαιώματα του νοσοκομειακού ασθενούς” ΦΕΚ 123/τ.Α.15/07/1992.) – το οποίο σχεδόν αποκλειστικά δεν γίνεται.