Επαναστατική η εξατομικευμένη κυτταρική θεραπεία CTL019 της Novartis σε ασθενείς με οξεία λεμφοβλαστική λευχαιμία
Η εξατομικευμένη κυτταρική θεραπεία CTL019 της Novartis λαμβάνει το χαρακτηρισμό της Επαναστατικής Θεραπείας από τον FDA
-
Ο χαρακτηρισμός υποστηρίζει την εξέλιξη του CTL019 για να βοηθήσει στην αντιμετώπιση της ακάλυπτης ανάγκης των ασθενών με υποτροπιάζουσα/ανθεκτική οξεία λεμφοβλαστική λευχαιμία (r/r ALL)
-
Η αίτηση υποβλήθηκε από την Ιατρική Σχολή Perelman του Πανεπιστημίου της Πενσυλβάνια, η οποία διενεργεί τις κλινικές μελέτες Φάσης I/II του CTL019
-
Η Novartis και το Πανεπιστήμιο της Πενσυλβάνια διατηρούν αποκλειστική παγκόσμια συνεργασία για την έρευνα, την ανάπτυξη και την εμπορική διάθεση θεραπειών CAR T κυττάρων για την ερευνητική θεραπεία του καρκίνου
Η Novartis ανακοίνωσε ότι ο Οργανισμός Τροφίμων και Φαρμάκων των Ηνωμένων Πολιτειών (FDA) έδωσε το χαρακτηρισμό της Επαναστατικής Θεραπείας στο CTL019, μία ερευνητική θεραπεία χιμαιρικών αντιγονικών υποδοχέων (CAR) για την αντιμετώπιση παιδιατρικών και ενηλίκων ασθενών με υποτροπιάζουσα/ ανθεκτική οξεία λεμφοβλαστική λευχαιμία (r/r ALL). Η αίτηση για το χαρακτηρισμό της Επαναστατικής Θεραπείας υποβλήθηκε από την Ιατρική Σχολή Perelman του Πανεπιστημίου της Πενσυλβάνια (Penn), η οποία έχει συνάψει αποκλειστική παγκόσμια συμφωνία με τη Novartis για την έρευνα, την ανάπτυξη και την εμπορική διάθεση εξατομικευμένων θεραπειών CAR T κυττάρων για την θεραπεία του καρκίνου.
Πρόκειται για την πέμπτη φορά που αποδίδεται χαρακτηρισμός Επαναστατικής Θεραπείας σε φάρμακο της Novartis, συνεχίζοντας την ηγετική πορεία της εταιρείας στην ανάπτυξη καινοτόμων θεραπειών για την αντιμετώπιση νόσων στις οποίες εξακολουθούν να υφίστανται σημαντικές ακάλυπτες ιατρικές ανάγκες1,2,3,4. Το Zykadia(TM) (ceritinib, προηγουμένως γνωστό ως LDK378) της Novartis, για την αντιμετώπιση του θετικού στην κινάση του αναπλαστικού λεμφώματος (ALK+) μεταστατικού μη μικροκυτταρικού καρκίνου του πνεύμονα (NSCLC), είναι ένα από τα πρώτα φάρμακα που εγκρίθηκαν από τον FDA ύστερα από την απόδοση του χαρακτηρισμού της Επαναστατικής Θεραπείας από τον FDA5.
«Ο χαρακτηρισμός του CTL019 ως Επαναστατική Θεραπεία υπογραμμίζει το ρόλο του ως θεραπεία που μπορεί να είναι σωτήρια για τη ζωή των ασθενών με υποτροπιάζουσα/ανθεκτική ALL, οι οποίοι χρειάζονται απεγνωσμένα νέες θεραπευτικές επιλογές,» είπε ο David Epstein, Επικεφαλής Τμήματος, Novartis Pharmaceuticals. «Η Novartis καλωσορίζει την ενίσχυση του διαλόγου με τον FDA και μία δυνητικά εσπευσμένη διαδικασία αξιολόγησης προκειμένου να επιταχυνθεί η ανάπτυξη του CTL019 με την ελπίδα αυτή η υποσχόμενη θεραπεία να καταστεί διαθέσιμη στους ασθενείς το ταχύτερο δυνατόν.»
Σύμφωνα με τον FDA, η απόδοση του χαρακτηρισμού της Επαναστατικής Θεραπείας αποσκοπεί στην επίσπευση της διαδικασίας ανάπτυξης και αξιολόγησης των νέων φαρμάκων που αντιμετωπίζουν σοβαρές ή απειλητικές για τη ζωή παθήσεις εφόσον έχουν επιδείξει σημαντική βελτίωση σε τουλάχιστον ένα κλινικά σημαντικό καταληκτικό σημείο έναντι μίας υπάρχουσας θεραπείας. Ο χαρακτηρισμός εμπεριέχει όλα τα χαρακτηριστικά ενός εσπευσμένου προγράμματος, καθώς και πιο εντατικές οδηγίες από τον FDA. Πρόκειται για έναν χαρακτηρισμό που διαφέρει από αυτόν της έγκρισης με εσπευσμένες διαδικασίες ή της αξιολόγησης κατά προτεραιότητα, οι οποίοι μπορούν επίσης να αποδοθούν στο ίδιο φάρμακο εάν πληρούνται τα σχετικά κριτήρια6.
«Πρόκειται για ένα σημαντικό ορόσημο καθώς βρισκόμαστε πλέον ένα βήμα πιο κοντά στην αντιμετώπιση των υψηλών ακάλυπτων αναγκών αυτού του πληθυσμού ασθενών,» είπε ο Carl H. June, Ιατρός, Καθηγητής Ανοσοθεραπείας στην Έδρα Richard W. Vague του τμήματος Παθολογοανατομίας και Εργαστηριακής Ιατρικής της Ιατρικής Σχολής Perelman και διευθυντής Μεταφραστικής Έρευνας στο Αντικαρκινικό Κέντρο Abramson του πανεπιστημίου της Πενσυλβάνια. «Είμαστε ενθουσιασμένοι με την ισχύ των θετικών πρώιμων στοιχείων που παρατηρήθηκαν σε παιδιατρικούς και ενήλικες ασθενείς με υποτροπιάζουσα/ ανθεκτική οξεία λεμφοβλαστική λευχαιμία και προσβλέπουμε στο να χρησιμοποιήσουμε αυτά τα ευρήματα ως βάση καθώς προχωράμε στις δοκιμές Φάσης II του κλινικού προγράμματος του CTL019.»
Προσφάτως, η Novartis ίδρυσε τη Μονάδα Κυτταρικών και Γονιδιακών Θεραπειών υπό την ηγεσία του Usman Azam, Παγκόσμιου Διευθυντή, προκειμένου να εντείνει το ενδιαφέρον για την εξέλιξη των καινοτόμων κυτταρικών θεραπειών, περιλαμβανομένης της εξέλιξης των CAR. Η Novartis κατέχει παγκοσμίως τα δικαιώματα των CAR που αναπτύσσονται μέσω της συνεργασίας με το Πανεπιστήμιο της Πενσυλβάνια για όλες τις ογκολογικές ενδείξεις, συμπεριλαμβανομένου του κύριου προγράμματος για το CTL019.
Σχετικά με το CTL019
Το CTL019 χρησιμοποιεί την τεχνολογία CAR για να επαναπρογραμματίσει τα T-κύτταρα του ίδιου του ασθενούς ώστε αυτά να «κυνηγήσουν» τα καρκινικά κύτταρα που εκφράζουν συγκεκριμένες πρωτεΐνες που ονομάζονται CD19. Αφότου επαναπρογραμματιστούν, τα T-κύτταρα (που ονομάζονται πλέον CTL019) επανεισάγονται στο αίμα του ασθενούς, πολλαπλασιάζονται και συνδέονται στα CD19+ καρκινικά κύτταρα-στόχους, τα οποία καταστρέφουν.
Επειδή το CTL019 είναι μία ερευνητική θεραπεία, τα προφίλ ασφάλειας και αποτελεσματικότητας δεν έχουν ακόμα τεκμηριωθεί. Η πρόσβαση σε ερευνητικές θεραπείες είναι διαθέσιμη μόνο μέσω προσεκτικά ελεγχόμενων και επιτηρούμενων κλινικών μελετών. Αυτές οι μελέτες έχουν σχεδιαστεί για την καλύτερη κατανόηση των ενδεχόμενων οφελών και κινδύνων της θεραπείας. Λόγω της αβεβαιότητας όσον αφορά στην έκβαση των κλινικών μελετών, δεν μπορεί να υπάρξει εγγύηση ότι το CTL019 θα καταστεί εμπορικά διαθέσιμο οποιαδήποτε στιγμή σε οποιοδήποτε μέρος του κόσμου.
Σχετικά με την οξεία λεμφοβλαστική λευχαιμία
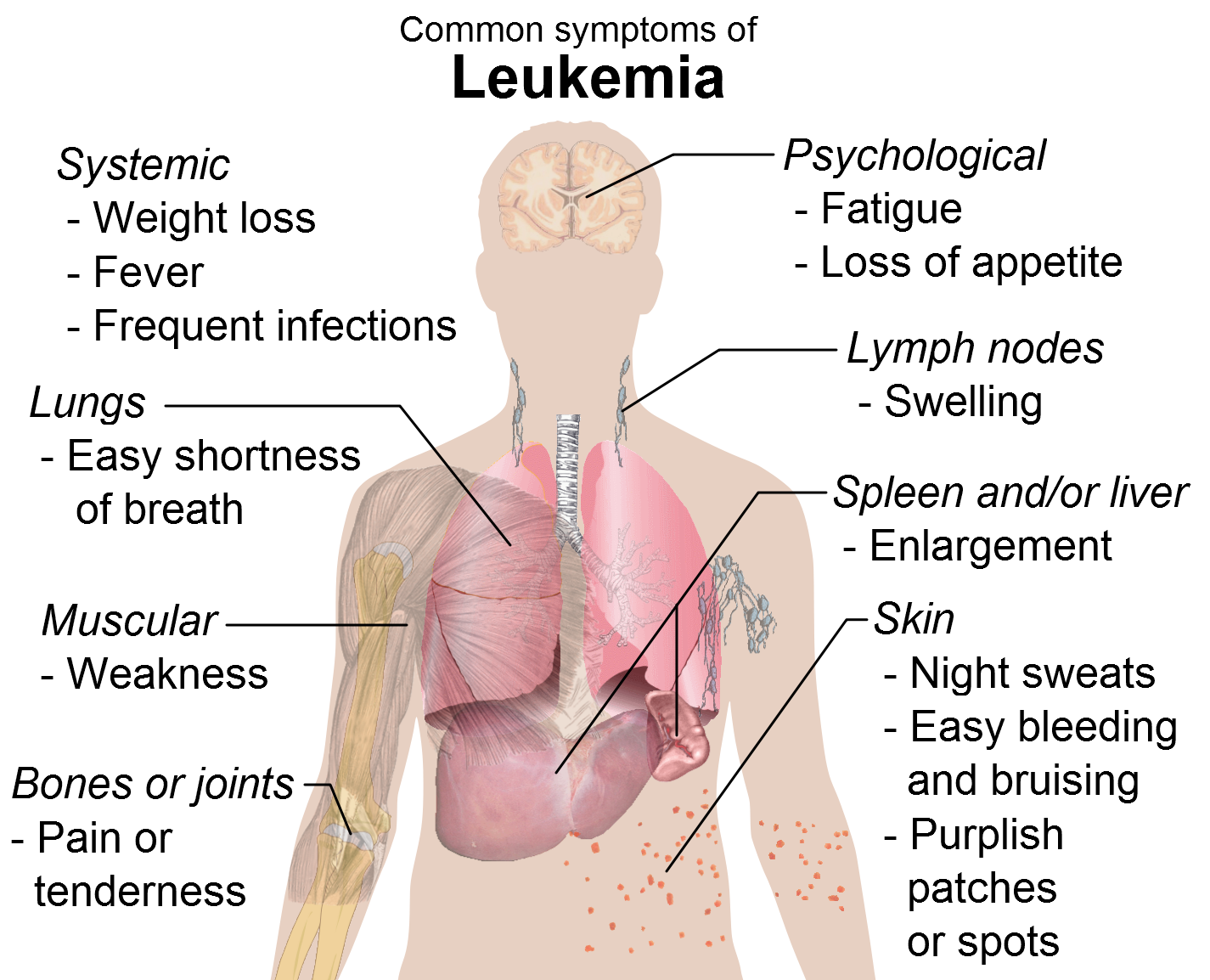
Η οξεία λεμφοβλαστική λευχαιμία (ALL) είναι ο πιο συχνός τύπος καρκίνου που διαγιγνώσκεται στα παιδιά και αντιπροσωπεύει περίπου το 25% των διαγνώσεων καρκίνου σε παιδιά κάτω των 15 ετών7. Μπορεί, επίσης, να εμφανιστεί στους ενήλικες. Η ALL είναι ένας τύπος καρκίνου κατά τον οποίο ο μυελός των οστών παράγει υπερβολική ποσότητα μη φυσιολογικών λευκών αιμοσφαιρίων (λεμφοκύτταρα). Η ALL συνήθως επιδεινώνεται γρήγορα εάν δεν αντιμετωπιστεί και μπορεί να αποβεί θανατηφόρος μέσα σε λίγους μήνες. Επομένως, η έναρξη θεραπείας συντόμως μετά από τη διάγνωση είναι κρίσιμης σημασίας για τους ασθενείς. Στους ασθενείς με υποτροπιάζουσα ALL, τα λευχαιμικά κύτταρα επανεμφανίζονται στο μυελό των οστών και παρουσιάζεται μείωση των φυσιολογικών κυττάρων του αίματος ύστερα από την ύφεση. Οι ασθενείς με ανθεκτική ALL εξακολουθούν να έχουν λευχαιμικά κύτταρα στο μυελό των οστών τους μετά από τη θεραπεία8.
Σχετικά με το Zykadia
Το Zykadia (ceritinib) ενδείκνυται στις ΗΠΑ για τη θεραπεία ασθενών με ALK+ μεταστατικό NSCLC, οι οποίοι έχουν παρουσιάσει εξέλιξη της νόσου υπό αγωγή με crizotinib ή έχουν εμφανίσει δυσανεξία στο crizotinib. Η ένδειξη αυτή εγκρίθηκε με εσπευσμένες διαδικασίες με βάση το ποσοστό ανταπόκρισης του όγκου και τη διάρκεια της ανταπόκρισης. Δεν έχει τεκμηριωθεί βελτίωση ως προς την επιβίωση ή τα συμπτώματα που σχετίζονται με τη νόσο. Η συνέχιση της ισχύος της έγκρισης για αυτή την ένδειξη γίνεται με την επιφύλαξη της επαλήθευσης και της περιγραφής του κλινικού οφέλους σε μελέτες επιβεβαίωσης.
Το Zykadia είναι ένα συνταγογραφούμενο φάρμακο που έχει εγκριθεί από τον FDA και διατίθεται αυτή τη στιγμή σε μία σειρά ειδικών φαρμακείων στις ΗΠΑ. Εκτός των ΗΠΑ, το Zykadia (LDK378) είναι ένας ερευνητικός παράγοντας και δεν έχει εγκριθεί από τις ρυθμιστικές αρχές.
Σημαντικές Πληροφορίες για την Ασφάλεια του Zykadia
Το Zykadia ενδέχεται να προκαλέσει σοβαρές ανεπιθύμητες ενέργειες, όπως:
Το Zykadia προκαλεί προβλήματα στο στόμαχο και το έντερο στους περισσότερους ανθρώπους, τα οποία περιλαμβάνουν διάρροια, ναυτία, έμετο και πόνο στην περιοχή του στομάχου. Τα προβλήματα αυτά μπορεί μερικές φορές να είναι σοβαρά. Οι ασθενείς θα πρέπει να ακολουθούν τις οδηγίες του γιατρού τους σχετικά με τη λήψη των φαρμάκων ώστε να βοηθήσουν στην αντιμετώπιση αυτών των συμπτωμάτων, και θα πρέπει να επικοινωνούν με το γιατρό τους για λήψη συμβουλών αν τα συμπτώματα είναι σοβαρά ή δεν υποχωρούν.
Το Zykadia μπορεί να προκαλέσει ηπατική βλάβη. Οι ασθενείς θα πρέπει να υποβάλλονται σε εξετάσεις αίματος τουλάχιστον μία φορά κάθε μήνα για όσο διάστημα παίρνουν το Zykadia και θα πρέπει να ενημερώνουν αμέσως το γιατρό τους αν εμφανίσουν οποιοδήποτε από τα ακόλουθα συμπτώματα: κούραση (κόπωση), κνησμός στο δέρμα, κίτρινο δέρμα και μάτια, ναυτία ή έμετος, ελαττωμένη όρεξη, πόνος στη δεξιά πλευρά του στομάχου, σκούρα ή καφέ ούρα, αιμορραγία ή μωλωπισμός πιο εύκολα από το φυσιολογικό.
Το Zykadia ενδέχεται να προκαλέσει σοβαρό ή απειλητικό για τη ζωή οίδημα (φλεγμονή) των πνευμόνων κατά τη διάρκεια της θεραπείας που μπορεί να οδηγήσει στο θάνατο. Τα συμπτώματα μπορεί να είναι παρόμοια με εκείνα του καρκίνου του πνεύμονα. Οι ασθενείς θα πρέπει να ενημερώνουν αμέσως το γιατρό τους σχετικά με κάθε νέο ή επιδεινούμενο σύμπτωμα, όπως δυσκολία στην αναπνοή ή λαχάνιασμα, πυρετός, βήχας, με ή χωρίς βλεννώδεις εκκρίσεις, ή πόνος στο θώρακα.
Το Zykadia μπορεί να προκαλέσει πολύ αργούς, πολύ γρήγορους ή ανώμαλους καρδιακούς χτύπους. Οι γιατροί θα πρέπει να ελέγχουν την καρδιά των ασθενών τους κατά τη διάρκεια της θεραπείας με το Zykadia. Οι ασθενείς θα πρέπει να ενημερώνουν αμέσως το γιατρό τους αν νιώσουν καινούργιο πόνο ή ενόχληση στο θώρακα, ζάλη ή τάση λιποθυμίας, αν λιποθυμήσουν, ή αν αρχίσουν να παίρνουν φάρμακα για την καρδιά ή την αρτηριακή πίεση ή αν κάνουν αλλαγές στα φάρμακα για την καρδιά ή την αρτηριακή πίεση που παίρνουν.
Οι άνθρωποι οι οποίοι έχουν διαβήτη ή δυσανεξία στη γλυκόζη, ή παίρνουν κάποιο κορτικοστεροειδές, διατρέχουν αυξημένο κίνδυνο εμφάνισης υψηλού σακχάρου στο αίμα με το Zykadia. Οι ασθενείς θα πρέπει να ακολουθούν τις οδηγίες του γιατρού τους σχετικά με την παρακολούθηση του σακχάρου του αίματος και να επικοινωνούν αμέσως με το γιατρό τους εάν εμφανιστεί οποιοδήποτε σύμπτωμα αυξημένου σακχάρου του αίματος, όπως αυξημένη δίψα, αυξημένη πείνα, πονοκέφαλοι, δυσκολία στη σκέψη ή στη συγκέντρωση, συχνή ούρηση, θαμπή όραση, κούραση, ή αναπνοή με οσμή φρούτων.
Προτού πάρουν το Zykadia, οι ασθενείς θα πρέπει να ενημερώσουν το γιατρό τους για όλα τα ιατρικά προβλήματα, συμπεριλαμβανομένων των ηπατικών προβλημάτων, του διαβήτη ή του υψηλού σακχάρου αίματος, για καρδιολογικά προβλήματα, περιλαμβανομένης μίας κατάστασης που ονομάζεται σύνδρομο μακρού QT, για το αν είναι έγκυος, αν πιστεύουν ότι μπορεί να είναι έγκυος ή αν προγραμματίζουν να μείνουν έγκυος, αν θηλάζουν ή αν προγραμματίζουν να θηλάσουν.
Το Zykadia ενδέχεται να βλάψει τα αγέννητα παιδιά. Οι γυναίκες σε αναπαραγωγική ηλικία πρέπει να χρησιμοποιούν μία αποτελεσματική μέθοδο αντισύλληψης στη διάρκεια της θεραπείας με το Zykadia και για τουλάχιστον 2 εβδομάδες μετά από τη διακοπή του Zykadia. Δεν είναι γνωστό αν το Zykadia περνά στο μητρικό γάλα. Οι ασθενείς και ο γιατρός τους θα πρέπει να αποφασίσουν αν θα πάρουν το Zykadia ή αν θα θηλάσουν, αλλά δεν θα πρέπει να κάνουν και τα δύο.
Οι ασθενείς θα πρέπει να ενημερώνουν το γιατρό τους σχετικά με τα φάρμακα που παίρνουν, συμπεριλαμβανομένων των συνταγογραφούμενων φαρμάκων, των μη συνταγογραφούμενων φαρμάκων, των βιταμινών και των φυτικών συμπληρωμάτων.
Οι πιο συχνές ανεπιθύμητες ενέργειες του Zykadia περιλαμβάνουν διάρροια, ναυτία, έμετο, κοιλιακό άλγος, κούραση (κόπωση), ελαττωμένη όρεξη και δυσκοιλιότητα.
Οι ασθενείς θα πρέπει να ενημερώσουν το γιατρό τους για κάθε ανεπιθύμητη ενέργεια που τους ενοχλεί ή που δεν υποχωρεί. Αυτές δεν είναι όλες οι πιθανές ανεπιθύμητες ενέργειες του Zykadia. Για περισσότερες πληροφορίες, θα πρέπει να ρωτήσετε το θεράποντα ιατρό ή το φαρμακοποιό σας.
Οι ασθενείς θα πρέπει να παίρνουν το Zykadia ακριβώς σύμφωνα με τις οδηγίες του θεράποντα ιατρού τους. Οι ασθενείς δεν θα πρέπει να αλλάζουν τη δόση τους ή να διακόπτουν τη λήψη του Zykadia εκτός αν λάβουν αυτή την οδηγία από το θεράποντα ιατρό τους. Το Zykadia θα πρέπει να λαμβάνεται μία φορά την ημέρα με άδειο στομάχι. Οι ασθενείς δεν θα πρέπει να τρώνε 2 ώρες πριν και 2 ώρες μετά τη λήψη του Zykadia. Αν ο ασθενής παραλείψει μία δόση του Zykadia, θα πρέπει να την πάρει αμέσως μόλις το θυμηθεί. Αν η επόμενη δόση πρόκειται να ληφθεί στις επόμενες 12 ώρες, θα πρέπει να παραλειφθεί η χαμένη δόση και να ληφθεί η επόμενη δόση την προγραμματισμένη ώρα. Οι ασθενείς δεν θα πρέπει να πίνουν χυμό γκρέιπφρουτ ή να τρώνε γκρέιπφρουτ κατά τη διάρκεια της θεραπείας με το Zykadia, καθώς μπορεί να προκαλέσουν αύξηση της ποσότητας του Zykadia στο αίμα σε επιβλαβές επίπεδο.
Παρακαλούμε ανατρέξτε στις πλήρεις Πληροφορίες Συνταγογράφησης για το Zykadia.
Δήλωση αποποίησης ευθύνης
Το παραπάνω δελτίο τύπου περιλαμβάνει δηλώσεις σχετικά με μελλοντικές εξελίξεις, οι οποίες μπορούν να εντοπιστούν σε φάσεις όπως «Επαναστατική Θεραπεία», «ερευνητική», «πορεία», «πιθανή», «ενδεχομένως», «με την ελπίδα», «υποσχόμενη», «μπορεί», «προσβλέπουμε», «συνεχίζοντας»ή σε παρόμοιες εκφράσεις ή σε ρητές ή έμμεσες διατυπώσεις όσον αφορά ενδεχόμενες μελλοντικές εγκρίσεις κυκλοφορίας για το CTL019 ή όσον αφορά ενδεχόμενα μελλοντικά έσοδα από το CTL019 και το Zykadia. Δεν θα πρέπει να βασίζεστε υπέρμετρα σε αυτές τις δηλώσεις. Τέτοιες δηλώσεις σχετικά με μελλοντικές εξελίξεις βασίζονται στις τρέχουσες πεποιθήσεις και προσδοκίες της διοίκησης σχετικά με μελλοντικά γεγονότα και υπόκεινται σε σημαντικούς γνωστούς και άγνωστους κινδύνους και αβεβαιότητες. Εάν ένας ή περισσότεροι από αυτούς τους κινδύνους ή τις αβεβαιότητες τελικά πραγματωθούν ή εάν οι υφιστάμενες παραδοχές αποδειχθούν εσφαλμένες, τα πραγματικά αποτελέσματα ενδέχεται να διαφέρουν ουσιωδώς από εκείνα που απορρέουν από τις δηλώσεις περί μελλοντικών εξελίξεων. Δεν μπορεί να υπάρξει εγγύηση ότι το CTL019 θα υποβληθεί για έγκριση ή θα εγκριθεί για πώληση σε οποιαδήποτε αγορά ή οποιαδήποτε συγκεκριμένη χρονική στιγμή. Ούτε μπορεί να υπάρξει καμία εγγύηση ότι το CTL019 ή το Zykadia θα είναι εμπορικά επιτυχημένα στο μέλλον. Συγκεκριμένα, οι προσδοκίες της διοίκησης σχετικά με το CTL019 και το Zykadia θα μπορούσαν να επηρεαστούν, μεταξύ άλλων πραγμάτων, από τις αβεβαιότητες που συνδέονται με την έρευνα και την ανάπτυξη, στις οποίες περιλαμβάνονται τα μη αναμενόμενα αποτελέσματα κλινικών μελετών και η επιπλέον ανάλυση των ήδη υπαρχόντων κλινικών στοιχείων, μη αναμενόμενες ρυθμιστικές ενέργειες ή καθυστερήσεις ή κυβερνητικές ρυθμίσεις γενικά, η δυνατότητα της εταιρείας να λάβει ή να διατηρήσει την προστασία της πνευματικής ιδιοκτησίας, οι γενικότερες συνθήκες στην οικονομία και τη βιομηχανία, οι παγκόσμιες τάσεις σχετικά με τους περιορισμούς στο κόστος της φροντίδας της υγείας, συμπεριλαμβανομένων των συνεχών πιέσεων τιμολόγησης, μη αναμενόμενα ζητήματα που αφορούν στην παρασκευή και άλλοι κίνδυνοι και παράγοντες που αναφέρονται στο Έντυπο 20-F της Novartis AG, το οποίο έχει κατατεθεί στην Επιτροπή Κεφαλαιαγοράς των ΗΠΑ. Στο παρόν δελτίο τύπου η Novartis παρέχει τις πληροφορίες που διαθέτει μέχρι αυτή τη στιγμή και δεν αναλαμβάνει οποιαδήποτε υποχρέωση για επικαιροποίηση των δηλώσεων περί μελλοντικών εξελίξεων που περιέχονται στο παρόν δελτίο τύπου ως αποτέλεσμα νέων πληροφοριών, μελλοντικών γεγονότων ή για οποιοδήποτε άλλο λόγο.
Σχετικά με τη Novartis
Η Novartis παρέχει καινοτόμες λύσεις για τη φροντίδα της υγείας, οι οποίες αντιμετωπίζουν τις αυξανόμενες ανάγκες των ασθενών και των κοινωνιών. Με έδρα στη Βασιλεία της Ελβετίας, η Novartis παρέχει ένα ποικιλόμορφο πορτοφόλιο, ώστε να ανταποκρίνεται καλύτερα σε αυτές τις ανάγκες: καινοτόμα φάρμακα, φροντίδα των οφθαλμών, οικονομικά γενόσημα φαρμακευτικά προϊόντα, προληπτικά εμβόλια, μη συνταγογραφούμενα προϊόντα και προϊόντα υγείας των ζώων. Η Novartis είναι η μόνη εταιρεία παγκοσμίως που κατέχει ηγετική θέση σε αυτά τα πεδία. Το 2013, ο Όμιλος πέτυχε καθαρές πωλήσεις 57,9 δισεκατομμυρίων δολαρίων ΗΠΑ, ενώ οι δαπάνες για Έρευνα και Ανάπτυξη σε ολόκληρο τον Όμιλο ανήλθαν σε περίπου 9,9 δισεκατομμύρια δολάρια ΗΠΑ (9,6 δισεκατομμύρια δολάρια ΗΠΑ αφαιρώντας τα έξοδα απομειώσεων και αποσβέσεων). Οι εταιρείες του Ομίλου Novartis απασχολούν περίπου 135.000 εργαζόμενους σε βάση ισοδυνάμου πλήρους απασχόλησης και πωλούν προϊόντα σε περισσότερες από 150 χώρες του κόσμου. Για περισσότερες πληροφορίες, παρακαλούμε να επισκεφτείτε τον ιστότοπο: http://www.novartis.com.
Βιβλιογραφικές παραπομπές
-
Novartis Press Release. “Novartis meningitis B vaccine Bexsero receives FDA Breakthrough Therapy designation in the US.” Available at: http://www.novartis.com/newsroom/media-releases/en/2014/1774805.shtml. Accessed June 2014.
-
Novartis Press Release. “Novartis compound LDK378 receives FDA Breakthrough Therapy designation for ALK+ non-small cell lung cancer.” Available at: http://www.novartis.com/newsroom/media-releases/en/2013/1685517.shtml. Accessed June 2014.
-
Novartis Press Release. “FDA grants Breakthrough Therapy designation to Novartis’ serelaxin (RLX030) for acute heart failure”. Available at: http://www.novartis.com/newsroom/media-releases/en/2013/1711047.shtml. Accessed June 2014.
-
Novartis Press Release. “Novartis receives FDA breakthrough therapy designation for BYM338 (bimagrumab) for sporadic inclusion body myositis (sIBM).” Available at:
http://www.novartis.com/newsroom/media–releases/en/2013/1723765.shtml.Accessed June 2014.
-
Novartis Press Release. “FDA Approves Zykadia (LDK378) in ALK+ Non-Small Cell Lung Cancer.” Available at: http://www.nibr.com/newsroom/stories/2014Apr30 FDA-Approves-Zykadia.shtml. Accessed June 2014.
-
US Food and Drug Administration. Frequently Asked Questions: Breakthrough Therapies. Available at: http://www.fda.gov/regulatoryinformation/legislation/federalfooddrugandcosmeticactfdcact/significantame ndmentstothefdcact/fdasia/ucm341027.htm. Accessed June 2014.
-
Howlader, N., Noone, A. M., Krapcho, M, et al. SEER Cancer Statistics Review, 1975-2010. National Cancer Institute, April 2013; Section 28.9 (12).
http://www.seer.cancer.gov/csr/1975 2010/results merged/sect 28 childhood cancer.pdf. Accessed June 2014.
-
Apostolidou, Effrosyni, et al. Treatment of Acute Lymphoblastic Leukaemia. Drugs 2007; 67 (15): 21532171.







