Νέο φάρμακο στη μάχη κατά της μεγαλακρίας απο τη Novartis.
Το φάρμακο Signifor® της Novartis εγκρίθηκε στην ΕΕ, σηματοδοτώντας μία εξέλιξη για τους ασθενείς με ανεπαρκώς ελεγχόμενη μεγαλακρία.
- Η μεγαλακρία είναι μία σπάνια διαταραχή της υπόφυσης, στην οποία απαιτείται ομαλοποίηση των ορμονικών επιπέδων ώστε να προληφθούν οι σοβαρές συνέπειες της νόσου 1,2,3,4
- Η έγκριση βασίστηκε σε δύο μεγάλες μελέτες φάσης III που δείχνουν ανώτερη αποτελεσματικότητα της νέας σύνθεσης του Signifor έναντι των σημερινών SSA σε ασθενείς με μεγαλακρία 5
- Επιπρόσθετες υποβολές αιτήσεων σε ρυθμιστικές αρχές για αυτή τη νέα σύνθεση μακράς διάρκειας δράσης του Signifor εξετάζονται αυτή τη στιγμή από υγειονομικές αρχές παγκοσμίως
Η Novartis ανακοίνωσε ότι η Ευρωπαϊκή Επιτροπή ενέκρινε το Signifor® (πασιρεοτίδη) ως μία νέα σύνθεση μακράς διάρκειας δράσης για ενδομυϊκή ενέσιμη χορήγηση για την αντιμετώπιση ενηλίκων ασθενών με μεγαλακρία για τους οποίους η χειρουργική επέμβαση δεν αποτελεί επιλογή ή δεν υπήρξε θεραπευτική και οι οποίοι είναι ανεπαρκώς ελεγχόμενοι υπό θεραπεία με άλλα ανάλογα σωματοστατίνης (SSA). Το SSA επόμενης γενιάς Signifor προσφέρει την πρώτη εναλλακτική θεραπευτική επιλογή στοχεύοντας άμεσα στον όγκο της υπόφυσης για τους ασθενείς των οποίων η μεγαλακρία παραμένει ανεπαρκώς ελεγχόμενη υπό αγωγή με τα SSA που είναι διαθέσιμα σήμερα5.
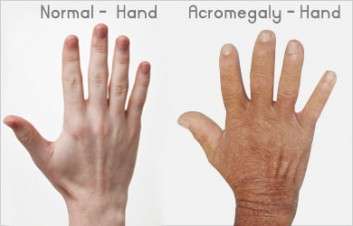
Εκτιμάται ότι η μεγαλακρία προσβάλλει ένα έως δύο ανά 10.000 άτομα στην ΕΕ6. Στην πλειοψηφία των περιπτώσεων μεγαλακρίας, ένας μη καρκινωματώδης όγκος στην υπόφυση οδηγεί σε υπερπαραγωγή της αυξητικής ορμόνης (GH) και, τελικά, του ινσουλινομιμητικού αυξητικού παράγοντα-1 (IGF-1) στον οργανισμό3. Η παρατεταμένη έκθεση στην GH και στον IGF-1 μπορεί να προκαλέσει στους ασθενείς την εμφάνιση σημαντικών φυσικών μεταβολών που περιλαμβάνουν την αύξηση του μεγέθους των χεριών, των ποδιών, των χαρακτηριστικών του προσώπου και των εσωτερικών οργάνων3. Επιπλέον, οι ασθενείς με μεγαλακρία που δεν επιτυγχάνουν βιοχημικό έλεγχο της νόσου τους, σύμφωνα με τις μετρήσεις των επιπέδων της GH και του IGF-1, ενδέχεται να αντιμετωπίσουν σοβαρές συνέπειες για την υγεία τους, όπως καρδιοπάθεια, υπέρταση, διαβήτη, αρθρίτιδα, καρκίνο του παχέος εντέρου, οι οποίες αυξάνουν τον κίνδυνο θανάτου3. Σύμφωνα με πρόσφατες έρευνες, 45% των ασθενών με μεγαλακρία αποτυγχάνουν να επιτύχουν τα συνιστώμενα επίπεδα GH ή ομαλοποιημένου IGF-1 με τις σημερινές θεραπείες2.
«Η μεγαλακρία που δεν ελέγχεται σωστά μπορεί να έχει καταστροφική επίδραση στη μακροχρόνια υγεία των ασθενών που πάσχουν από αυτή τη σοβαρή διαταραχή της υπόφυσης», είπε ο Bruno Strigini, Πρόεδρος της Novartis Oncology. «Αυτή η πρώτη έγκριση του Signifor στη μεγαλακρία σηματοδοτεί μία πολύ αναγκαία εξέλιξη στην αντιμετώπιση αυτής της σπάνιας νόσου και εργαζόμαστε σκληρά ώστε να παρέχουμε αυτή τη θεραπεία σε αυτόν τον ανεπαρκώς αντιμετωπιζόμενο πληθυσμό ασθενών παγκοσμίως στο εγγύς μέλλον».
Η έγκριση βασίζεται σε στοιχεία από δύο πολυκεντρικές μελέτες Φάσης III, την C2402 και την C2305, οι οποίες αξιολόγησαν, αντίστοιχα, ασθενείς με ανεπαρκώς ελεγχόμενη μεγαλακρία υπό αγωγή με SSA πρώτης γενιάς, και ασθενείς που δεν είχαν λάβει προηγουμένως ιατρική θεραπεία, οι οποίοι είχαν χειρουργηθεί στο παρελθόν ή νεοδιαγνωσμένους ασθενείς για τους οποίους η χειρουργική επέμβαση αντενδείκνυται. Και οι δύο μελέτες έδειξαν ότι το Signifor έχει ανώτερη αποτελεσματικότητα ως προς την επίτευξη βιοχημικού ελέγχου, σύμφωνα με τη μέτρηση των επιπέδων της GH και του IGF-1, συγκριτικά με ένα SSA πρώτης γενιάς5. Η έγκριση από την ΕΕ έρχεται μετά από μία θετική γνωμοδότηση της Επιτροπής Φαρμακευτικών Προϊόντων για Χρήση στον Άνθρωπο (CHMP) για το Signifor το Σεπτέμβριο του 2014 για την αντιμετώπιση της μεγαλακρίας και ισχύει και στα 27 κράτη-μέλη της ΕΕ, καθώς και στην Ισλανδία και τη Νορβηγία7. Επιπρόσθετες αιτήσεις σε ρυθμιστικές αρχές για τη νέα σύνθεση μακράς διάρκειας δράσης του Signifor έχουν υποβληθεί παγκοσμίως για την αντιμετώπιση της μεγαλακρίας, συμπεριλαμβανομένης μίας αίτησης που βρίσκεται σε εξέλιξη στις Ηνωμένες Πολιτείες. Στην ΕΕ, το Signifor χαρακτηρίζεται ως ορφανό φάρμακο για τη μεγαλακρία8. Ορφανά φάρμακα είναι αυτά που αντιμετωπίζουν μία πάθηση η οποία προσβάλλει όχι περισσότερα από πέντε στα 10.000 άτομα στην ΕΕ9.
Σχετικά με τη μελέτη C2402
Η Φάσης III πολυκεντρική, τυχαιοποιημένη, τριών σκελών μελέτη παράλληλων ομάδων C2402 αξιολόγησε την αποτελεσματικότητα και την ασφάλεια της διπλά τυφλής ενέσιμης ενδομυϊκής χορήγησης 40 mg και 60 mg του Signifor έναντι των μέγιστων δόσεων του Sandostatin LAR ή του Somatuline Autogel* σε ασθενείς με ανεπαρκώς ελεγχόμενη μεγαλακρία που αντιμετωπίστηκαν για τουλάχιστον 6 μήνες με πρώτης γενιάς SSA. Ο κύριος στόχος αποτελεσματικότητας ήταν να συγκριθεί η αναλογία των ασθενών που πέτυχαν βιοχημικό έλεγχο (που ορίζεται ως μέσα επίπεδα GH <2,5 μg/L και ομαλοποίηση του προσαρμοσμένου κατά φύλο και ηλικία IGF-1) με το Signifor 40 και 60 mg ξεχωριστά, έναντι του δραστικού φαρμάκου ελέγχου που αντιπροσωπεύεται από το Sandostatin LAR και το Somatuline Autogel. Το κύριο καταληκτικό σημείο επετεύχθη και στις δύο δοσολογικές ομάδες του Signifor με 15,4% (P=0,0006) και 20,0% (P<0,0001) των ασθενών που έλαβαν Signifor 40 mg και 60 mg να επιτυγχάνουν βιοχημικό έλεγχο, αντίστοιχα, συγκριτικά με μηδέν στο σκέλος του δραστικού φαρμάκου ελέγχου. Στους ασθενείς που αντιμετωπίστηκαν με Signifor στους οποίους παρατηρήθηκαν μειώσεις των GH και IGF-1, οι μεταβολές αυτές συνέβησαν στη διάρκεια των πρώτων 3 μηνών της θεραπείας και διατηρήθηκαν την εβδομάδα 245. Επιπλέον, 24,6% (P<0,0001) και 26,2% (P<0,0001) των ασθενών που έλαβαν Signifor 40 mg και 60 mg πέτυχαν ομαλοποίηση του IGF-1, αντίστοιχα, συγκριτικά με μηδέν στο σκέλος του δραστικού φαρμάκου ελέγχου. Το 35,4% και το 43,1% των ασθενών που έλαβαν Signifor 40 mg και 60 mg πέτυχαν επίπεδα GH <2,5 μg/l, αντίστοιχα, συγκριτικά με 13,2% στο σκέλος του δραστικού φαρμάκου ελέγχου. Υψηλότερο ποσοστό ασθενών υπό αγωγή με το Signifor (18,5% και 10,8% για τα 40 και τα 60 mg, αντίστοιχα) πέτυχε μία ελάττωση στο μέγεθος του όγκου τουλάχιστον 25% έναντι 1,5% με το δραστικό φάρμακο ελέγχου5.
Οι πιο συχνές ανεπιθύμητες ενέργειες που παρατηρήθηκαν (συχνότητα ≥20%) και στα δύο σκέλη του Signifor ήταν υπεργλυκαιμία και σακχαρώδης διαβήτης. Οι ανεπιθύμητες ενέργειες Βαθμού 3 και 4 σύμφωνα με τα Συνήθη Κριτήρια Τοξικότητας (CTC) σχετίζονταν κυρίως με υπεργλυκαιμία2.
Σχετικά με τη μελέτη C2305
Στη Φάσης III, πολυκεντρική, τυχαιοποιημένη, τυφλή μελέτη, οι ασθενείς με ενεργό μεγαλακρία που δεν είχαν λάβει ιατρική θεραπεία στο παρελθόν έλαβαν είτε ενδομυϊκή ένεση Signifor (δόση έναρξης 40 mg με δυνατότητα προς τα άνω τιτλοποίησης έως τα 60 mg) είτε Sandostatin LAR (δόση έναρξης 20 mg με δυνατότητα προς τα άνω τιτλοποίησης έως τα 30 mg) για 12 μήνες. Οι πρωτοθεραπευόμενοι με ιατρική θεραπεία ασθενείς που εντάχθηκαν στη μελέτη περιελάμβαναν ασθενείς μετά από χειρουργική επέμβαση, ή νεοδιαγνωσθέντες ασθενείς για τους οποίους υπήρχε αντένδειξη για χειρουργική επέμβαση. Το κύριο καταληκτικό σημείο επετεύχθη, επιδεικνύοντας την ανωτερότητα του Signifor έναντι του Sandostatin LAR ως προς την παροχή βιοχημικού ελέγχου, όπως ορίζεται από την αναλογία των ασθενών με ελάττωση του μέσου επιπέδου GH σε <2,5 μg/l και την ομαλοποίηση του IGF-1 εντός των φυσιολογικών ορίων. Συγκεκριμένα, το 31,3% και το 19,2% των ασθενών πέτυχαν βιοχημικό έλεγχο υπό αγωγή με Signifor και με Sandostatin LAR, αντίστοιχα, επιδεικνύοντας ένα στατιστικά σημαντικά ανώτερο αποτέλεσμα υπέρ του Signifor (P=0,007). Επιπλέον, το 80,8% των ασθενών πέτυχαν ελάττωση του μεγέθους του όγκου μεγαλύτερη από 20% με το Signifor συγκριτικά με 77,4% με το Sandostatin LAR5.
Οι πιο συχνές ανεπιθύμητες ενέργειες που παρατηρήθηκαν (συχνότητα ≥20%) με το Signifor ήταν διάρροια, χολολιθίαση, υπεργλυκαιμία και σακχαρώδης διαβήτης. Οι ανεπιθύμητες ενέργειες Βαθμού 3 και 4 σύμφωνα με τα Συνήθη Κριτήρια Τοξικότητας (CTC) σχετίζονταν κυρίως με υπεργλυκαιμία5.
Σχετικά με τη μεγαλακρία
Παγκοσμίως, ο επιπολασμός της μεγαλακρίας εκτιμάται σε 60 περιπτώσεις ανά εκατομμύριο πληθυσμού, με ετήσια επίπτωση 3 έως 4 νέων περιπτώσεων ανά εκατομμύριο πληθυσμού3. Ωστόσο, πρόσφατες μελέτες υποδηλώνουν ότι τα αδενώματα της υπόφυσης ενδέχεται να έχουν μεγαλύτερο επιπολασμό από ό,τι θεωρούνταν στο παρελθόν, και ότι ο επιπολασμός της μεγαλακρίας ενδέχεται να κυμαίνεται μεταξύ 115 και 295 περιπτώσεων ανά εκατομμύριο πληθυσμού παγκοσμίως10. Η μεγαλακρία συνηθέστερα παρουσιάζεται σε άνδρες και γυναίκες μέσης ηλικίας3. Η εξουθενωτική αυτή νόσος μπορεί να είναι δύσκολο να ανιχνευθεί επειδή μπορεί να αναπτυχθεί βαθμιαία και/ή τα επιμέρους συμπτώματα ενδέχεται να εκληφθούν εσφαλμένα ως κάποια άλλη ιατρική πάθηση, με το μέσο όρο της καθυστέρησης από την έναρξη της νόσου μέχρι τη διάγνωση να κυμαίνεται μεταξύ 6 και 10 ετών3,10,11. Η μεγαλακρία συσχετίζεται επίσης με δύο έως τρεις φορές αυξημένα ποσοστά θνητότητας και σοβαρές επιπλοκές στην υγεία, που περιλαμβάνουν καρδιοπάθεια, υπέρταση, διαβήτη, αρθρίτιδα, και καρκίνο του παχέος εντέρου1,3,4. Στην πραγματικότητα, η καρδιοπάθεια ευθύνεται για περίπου 60% των θανάτων στα άτομα με μεγαλακρία12.
Σχετικά με το Signifo
Το Signifor ενδείκνυται για την αντιμετώπιση ενήλικων ασθενών με μεγαλακρία για τους οποίους η χειρουργική επέμβαση δεν αποτελεί επιλογή ή δεν υπήρξε θεραπευτική και οι οποίοι είναι ανεπαρκώς ελεγχόμενοι υπό θεραπεία με άλλα ανάλογα σωματοστατίνης.