Η AbbVie έλαβε έγκριση από την Ευρωπαϊκή Επιτροπή για το venetoclax

σε συνδυασμό με rituximab για τη θεραπεία ασθενών με Χρόνια Λεμφοκυτταρική Λευχαιμία, οι οποίοι έχουν λάβει τουλάχιστον μία προηγούμενη θεραπεία.
- Η έγκριση βασίζεται στην κλινική μελέτη Φάσης 3 MURANO, στην οποία το venetoclax σε συνδυασμό με rituximab μείωσε τον κίνδυνο εξέλιξης της νόσου ή θανάτου κατά 83% και παρέτεινε τη συνολική επιβίωση, σε σύγκριση με το συνδυασμό bendamustine καιrituximab, ένα καθιερωμένο σχήμα ανοσοχημειοθεραπείας[1]
- Οι περισσότεροι ασθενείς (62,4%) που έλαβαν θεραπεία με venetoclax σε συνδυασμό με rituximab πέτυχαν υψηλά ποσοστά μη ανιχνεύσιμης ελάχιστης υπολειμματικής νόσου (γνωστή και ως αρνητικό αποτέλεσμα για MRD (Minimal Residual Disease) στο περιφερικό αίμα σε σύγκριση με το 13,3% των ασθενών που έλαβαν θεραπεία συνδυασμό bendamustine με rituximab1
- Η έγκριση αυτή καθιστά το venetoclax σε συνδυασμό με rituximab την πρώτη συνδυαστική θεραπεία χωρίς χημειοθεραπεία με καθορισμένη διάρκεια θεραπείας 24 μηνών για ασθενείς με Χρόνια Λεμφοκυτταρική Λευχαιμία, οι οποίοι έχουν λάβει τουλάχιστον μία προηγούμενη θεραπεία
ΒΟΡΕΙΟ ΣΙΚΑΓΟ, Ιλινόις, 31 Οκτωβρίου 2018 – Η AbbVie (NYSE: ABBV), μία παγκόσμια βιοφαρμακευτική εταιρεία που βασίζεται στην έρευνα, ανακοίνωσε σήμερα ότι η Ευρωπαϊκή Επιτροπή ενέκρινε την αίτηση τροποποίησης τύπου II για το venetoclax σε συνδυασμό με rituximab για τη θεραπεία ασθενών με υποτροπιάζουσα/ανθεκτική Χρόνια Λεμφοκυτταρική Λευχαιμία (ΧΛΛ), οι οποίοι έχουν λάβει τουλάχιστον μία προηγούμενη θεραπεία. Αυτή η έγκριση επιτρέπει σε περισσότερους ασθενείς να λάβουν θεραπεία με venetoclax σαν θεραπεία δεύτερης γραμμής και παρέχει στους ιατρούς τη δυνατότητα να χορηγήσουν το συγκεκριμένο φάρμακο σε έναν ευρύτερο πληθυσμό ασθενών με υποτροπιάζουσα/ανθεκτική χρόνια ΧΛΛ, από αυτό που προβλέπει η προηγούμενη εγκεκριμένη ένδειξη για το venetoclax ως μονοθεραπεία στην Ευρωπαϊκή Ένωση (ΕΕ). Η έγκριση ισχύει στα 28 κράτη-μέλη της Ευρωπαϊκής Ένωσης, καθώς και στην Ισλανδία, το Λιχτενστάιν και τη Νορβηγία.
Η έγκριση της Ευρωπαϊκής Επιτροπής βασίζεται στα αποτελέσματα της τυχαιοποιημένης κλινικής μελέτης Φάσης 3 MURANO, η οποία αξιολόγησε την αποτελεσματικότητα και την ασφάλεια του venetoclax σε συνδυασμό με rituximab σε σύγκριση με το συνδυασμό bendamustine σε με rituximab, ως καθιερωμένο σχήμα ανοσοχημειοθεραπείας για ασθενείς με υποτροπιάζουσα/ανθεκτική χρόνια ΧΛΛ.1 Κατά την αρχική ανάλυση, η μελέτη έδειξε στατιστικά σημαντική βελτίωση της επιβίωσης χωρίς εξέλιξη της νόσου (PFS· χρονικό διάστημα χωρίς εξέλιξη της νόσου ή θάνατο[2]) κατά την εκτίμηση του ερευνητή για τους ασθενείς που έλαβαν venetoclax σε συνδυασμό με rituximab, με αποτέλεσμα τη μείωση κατά 83% του κινδύνου εξέλιξης της νόσου ή θανάτου (αναλογία κινδύνου [HR]:0,17· 95% διάστημα εμπιστοσύνης [CI]: 0,11-0,25· P<0,001), καθώς και την παρατεταμένη συνολική επιβίωση (OS) σε σύγκριση με το καθιερωμένο σχήμα ανοσοχημειοθεραπείας (HR: 0,48· 95% CI: 0,25-0,90· τα δεδομένα συνολικής επιβίωσης δεν είναι ακόμη ώριμα).1
Στην κλινική μελέτη Φάσης 3 MURANO, η μη ανιχνεύσιμη ελάχιστη υπολειμματική νόσος [undetectable Minimal Residual Disease (uMRD)] αξιολογήθηκε ως δευτερεύον καταληκτικό σημείο στο τέλος της συνδυαστικής θεραπείας (αξιολόγηση διάρκειας εννέα μηνών1,[3]). Οι περισσότεροι ασθενείς στο πλαίσιο της μελέτης που έλαβαν venetoclax σε συνδυασμό με rituximab πέτυχαν uMRD στο περιφερικό αίμα, με το 62,4% των ασθενών να πετυχαίνει uMRD έναντι 13,3% ασθενών που έλαβαν bendamustine σε συνδυασμό με rituximab.1 Το uMRD αποτελεί έναν αντικειμενικό δείκτη μέτρησης της νόσου και ορίζεται από την παρουσία λιγότερων του ενός λευχαιμικού κυττάρου ΧΛΛ ανά 10.000 λεμφοκύτταρα στο αίμα ή στον μυελό τον οστών μετά το τέλος της θεραπείας.2 Προοπτικές κλινικές μελέτες έχουν αποδείξει ότι η επίτευξη του uMRD σε ασθενείς με ΧΛΛ συσχετίζεται με ένα βελτιωμένο κλινικών αποτέλεσμα.2
«Η ΧΛΛ είναι δυνατό να υποτροπιάσει και να καταστεί ανθεκτική στην πρώτη γραμμής θεραπεία, συνεπώς υφίσταται ανάγκη για καλύτερες θεραπείες στην αντιμετώπιση αυτών των ασθενών οι οποίοι διαφορετικά θα είχαν περιορισμένες επιλογές», δήλωσε ο Καθηγητής John Seymour, MBBS, Ph.D., κύριος ερευνητής της κλινικής μελέτης MURANO και Διευθυντής Ιατρικής του Καρκίνου στο Αντικαρκινικό Κέντρο Peter MacCallum & το Νοσοκομείο Royal Melbourne στην Αυστραλία. «Η χρήση του venetoclax σε συνδυασμό με rituximab προσφέρει σε αυτούς τους ασθενείς μία εναλλακτική θεραπευτική επιλογή που είναι ανώτερη από ένα είδος ανοσοχημειοθεραπείας και είναι δυνατό να πετύχει σημαντική ανταπόκριση, όπως αποδεικνύεται από τα ποσοστά αρνητικού αποτελέσματος για MRD στο περιφερικό αίμα και τον μυελό των οστών, επιτρέποντας τη χορήγηση μιας θεραπείας καθορισμένης διάρκειας χωρίς ανοσοχημειοθεραπεία».
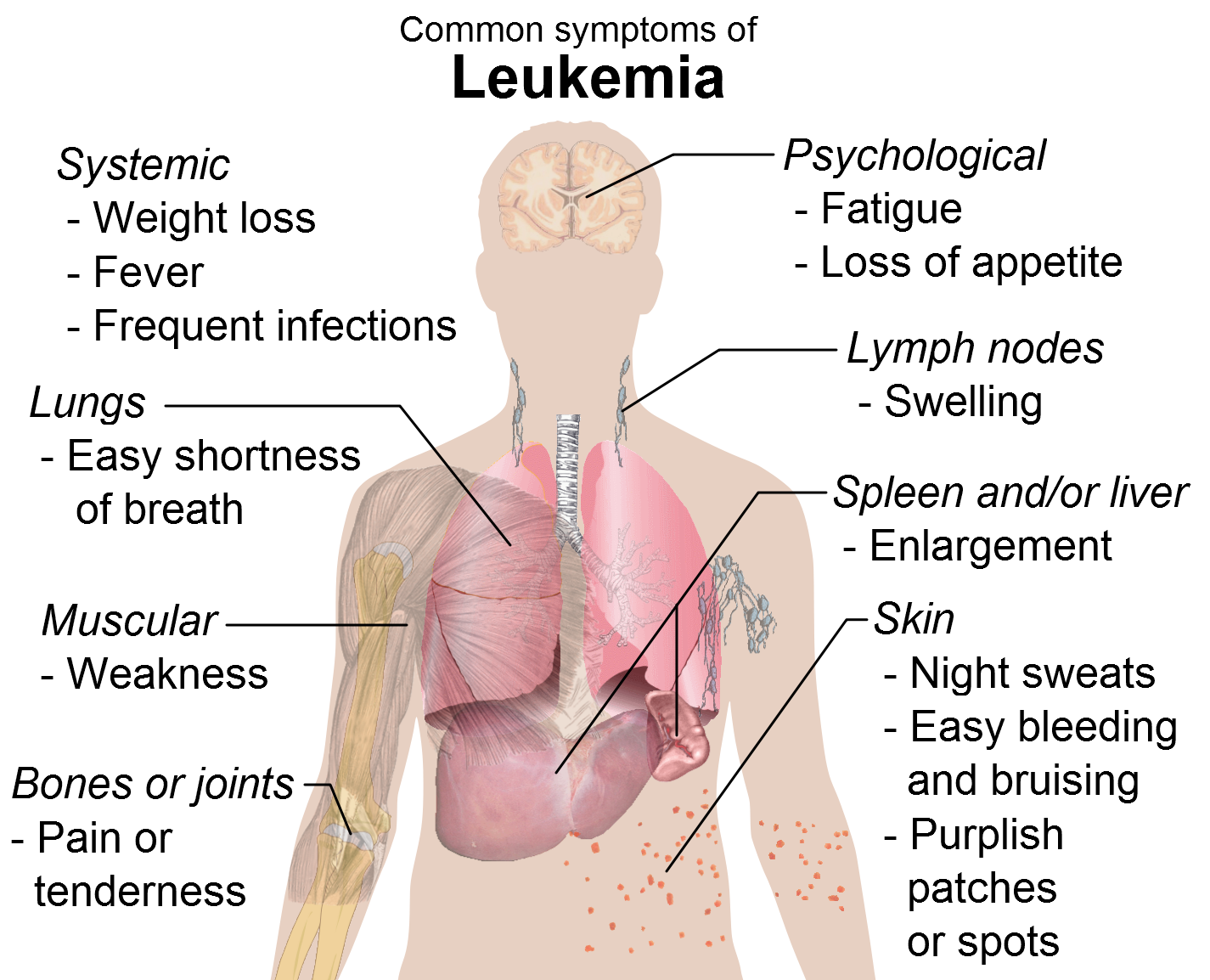
Η ΧΛΛ είναι μία βραδείας εξέλιξης μορφή λευχαιμίας, που χαρακτηρίζεται από την προοδευτική μονοκλωνική αύξηση του αριθμού των Β-λεμφοκυττάρων, τα οποία αθροίζονται στους λεμφικούς ιστούς, στο μυελό και το αίμα.[4] Η ΧΛΛ αντιστοιχεί περίπου στο ένα τρίτο των νεοδιαγνωσθέντων περιστατικών λευχαιμίας.[5]
Τον Σεπτέμβριο του 2018, η AbbVie ανακοίνωσε ότι η Ευρωπαϊκή Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) εξέδωσε θετική γνωμοδότηση για τη χορήγηση άδειας κυκλοφορίας στο venetoclax σε συνδυασμό με rituximab για τη θεραπεία ασθενών με υποτροπιάζουσα/ανθεκτική ΧΛΛ.
«Η έγκριση του venetoclax σε συνδυασμό με rituximab αποτελεί ένα σημαντικό βήμα προόδου όσον αφορά τη δυνατότητα να προσφέρουμε στους ασθενείς με υποτροπιάζουσα/ανθεκτική ΧΛΛ σοβαρές πιθανότητες να ζήσουν περισσότερο χωρίς να εξελιχθεί η νόσος τους», δήλωσε ο Michael Severino, M.D., Εκτελεστικός Αντιπρόεδρος του Τμήματος Έρευνας και Ανάπτυξης και chief scientific officer της AbbVie. «Ανυπομονούμε να προσφέρουμε το venetoclax σε περισσότερους ασθενείς με ΧΛΛ, ενώ συνεχίζουμε να προωθούμε την έρευνα και την ανάπτυξη θεραπειών με τη δυνατότητα να μετασχηματίσουν τις καθιερωμένες θεραπείες στις αιματολογικές κακοήθειες».
Το venetoclax αναπτύσσεται από την AbbVie και τη Roche. Στις ΗΠΑ διατίθεται από την AbbVie και τη Genentech, μέλος του Ομίλου Roche, ενώ σε όλες τις υπόλοιπες χώρες διατίθεται από την AbbVie.
Σχετικά με την κλινική μελέτη MURANO
Συνολικά 389 ασθενείς με υποτροπιάζουσα/ανθεκτική ΧΛΛ οι οποίοι είχαν λάβει τουλάχιστον μία προηγούμενη θεραπεία συμμετείχαν στη διεθνή, πολυκεντρική, ανοικτή, τυχαιοποιημένη κλινική μελέτη Φάσης 3 MURANO. Η μελέτη σχεδιάστηκε για να αξιολογήσει την αποτελεσματικότητα και την ασφάλεια του venetoclax σε συνδυασμό με rituximab (N=194) σε σύγκριση με bendamustine σε συνδυασμό με rituximab (N=195). Η διάμεση ηλικία των ασθενών της μελέτης ήταν 65 έτη (εύρος: 22-85).1
Το πρωτεύον καταληκτικό σημείο αποτελεσματικότητας ήταν η επιβίωση χωρίς εξέλιξη της νόσου (PFS) κατά την εκτίμηση του ερευνητή (INV). Η διάμεση επιβίωση χωρίς εξέλιξη της νόσου (PFS) με venetoclax σε συνδυασμό με rituximab δεν έχει επιτευχθεί ακόμη. Στο σκέλος της bendamustine σε συνδυασμό με rituximab το PFS είναι 17 μήνες (HR: 0.17; 95% CI: 0.11-0.25; P<0.001). Το διάμεσο χρονικό διάστημα παρακολούθησης (follow-up) ήταν 23,8 μήνες (εύρος: 0,0 έως 37,4). Πρόσθετα καταληκτικά σημεία αποτελεσματικότητας ήταν η επιβίωση χωρίς εξέλιξη της νόσου κατά την εκτίμηση της ανεξάρτητης επιτροπής αξιολόγησης (IRC), το συνολικό ποσοστό ανταπόκρισης (που ορίστηκε ως πλήρης ύφεση + πλήρης ύφεση με ατελή ανάκαμψη του μυελού + μερική ύφεση + μερική ύφεση με μυελικά λεμφοζίδια), η συνολική επιβίωση και τα ποσοστά μη ανιχνεύσιμης ελάχιστης υπολειμματικής νόσου (uMRD) κατά την εκτίμηση του ερευνητή (INV) και κατά την εκτίμηση της ανεξάρτητης επιτροπής αξιολόγησης (IRC).1
Το προφίλ ασφάλειας του venetoclax σε συνδυασμό με rituximab είναι συνεπές με το γνωστό προφίλ ασφάλειας κάθε φαρμάκου χωριστά. Οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες (ΑΕ· ≥20 percent) οποιουδήποτε βαθμού για το venetoclax σε συνδυασμό με rituximab ήταν ουδετεροπενία, διάρροια και λοίμωξη του ανώτερου αναπνευστικού συστήματος. Στο σκέλος θεραπείας με venetoclax σε συνδυασμό με rituximab, κατεγράφη διακοπή θεραπείας λόγω ανεπιθύμητων ενεργειών στο 16% των ασθενών, μείωση δόσης στο 15% και διακοπή δόσης στο 71%. Στο σκέλος θεραπείας με venetoclax σε συνδυασμό με rituximab, η εμφάνιση ουδετεροπενίας οδήγησε σε διακοπή δόσης του venetoclax στο 43% των ασθενών και σε διακοπή της θεραπείας στο 3%. Οι πιο σοβαρές ανεπιθύμητες ενέργειες (≥2%) για το venetoclax σε συνδυασμό με rituximab ή το venetoclax ως μονοθεραπεία ήταν πνευμονία, εμπύρετη ουδετεροπενία και σύνδρομο λύσης όγκου (TLS).1
Σχετικά με το venetoclax
Το venetoclax αποτελεί την πρώτη στην κατηγορία της θεραπεία (first-in-class) που δεσμεύει εκλεκτικά και αναστέλλει την πρωτεΐνη BCL-2 (B-cell lymphoma-2). Σε ορισμένες αιματολογικές κακοήθειες και άλλους καρκινικούς όγκους, η BCL-2 συσσωρεύεται και αποτρέπει τον φυσικό θάνατο των καρκινικών κυττάρων ή τη διαδικασία αυτοκαταστροφής, που ονομάζεται απόπτωση. Το venetoclax στοχεύει την πρωτεΐνη BCL-2 προκειμένου να συμβάλει στην αποκατάσταση της διαδικασίας της απόπτωσης.
Το venetoclax αναπτύσσεται από την AbbVie και τη Roche. Στις ΗΠΑ διατίθεται από την AbbVie και τη Genentech, μέλος του Ομίλου Roche, ενώ σε όλες τις υπόλοιπες χώρες διατίθεται από την AbbVie. Οι εταιρείες έχουν αφοσιωθεί από κοινού στην έρευνα της BCL-2 με το venetoclax, το οποίο αξιολογείται επί του παρόντος σε κλινικές μελέτες για τη θεραπεία πολλών αιματολογικών κακοηθειών.
Το venetoclax έχει λάβει έγκριση σε περισσότερες από 50 χώρες, συμπεριλαμβανομένων των ΗΠΑ. Επί του παρόντος, η AbbVie και η Roche συνεργάζονται με ρυθμιστικές αρχές σε ολόκληρο τον κόσμο για να προσφέρουν το συγκεκριμένο φάρμακο σε περισσότερους ασθενείς που έχουν κριθεί κατάλληλοι για θεραπεία και το χρειάζονται.
Σημαντικές Πληροφορίες Ασφάλειας του venetoclax για την ΕΕ3
Αντενδείξεις
Αντενδείκνυται η χρήση σε ασθενείς με υπερευαισθησία στη δραστική ουσία ή σε κάποιο από τα έκδοχα. Η ταυτόχρονη χρήση με ισχυρούς αναστολείς του CYP3A κατά την έναρξη και κατά τη διάρκεια της φάσης τιτλοποίησης της δόσης λόγω αυξημένου κινδύνου εμφάνισης συνδρόμου λύσης όγκου (TLS). Η ταυτόχρονη χρήση σκευασμάτων που περιέχουν St. John’s wort (βαλσαμόχορτο), καθώς μπορεί να μειωθεί η αποτελεσματικότητα του venetoclax.
Ειδικές πpοειδοποιήσεις και προφυλάξεις κατά τη χρήση
Σε ασθενείς με προηγούμενη θεραπεία για ΧΛΛ με υψηλό φορτίο όγκου, αναφέρθηκαν περιστατικά συνδρόμου λύσης όγκου, συμπεριλαμβανομένων περιστατικών με θανατηφόρο έκβαση, όταν έλαβαν θεραπεία με venetoclax. To venetoclax ενέχει κίνδυνο εμφάνισης TLS στην αρχική φάση τιτλοποίησης της δόσης, διάρκειας 5 εβδομάδων. Μεταβολές στους ηλεκτρολύτες που συνάδουν με TLS, οι οποίες απαιτούν έγκαιρη αντιμετώπιση μπορεί να συμβούν 6 με 8 ώρες μετά την πρώτη δόση venetoclax καθώς και σε κάθε αύξηση της δόσης. Οι ασθενείς πρέπει να αξιολογούνται για τον κίνδυνο πρέπει να λαμβάνουν κατάλληλη προφύλαξη, παρακολούθηση και διαχείριση για TLS.
Έχει αναφερθεί ουδετεροπενία (3ου ή 4ου βαθμού) και πρέπει να γίνεται πλήρης αιματολογικός έλεγχος καθ’ όλη τη διάρκεια της θεραπείας. Έχουν αναφερθεί σοβαρές λοιμώξεις συμπεριλαμβανομένων συμβάντων σηψαιμίας με θανατηφόρο έκβαση. Υποστηρικτικά μέτρα που περιλαμβάνουν τα αντιμικροβιακά για τυχόν σημεία λοίμωξης πρέπει να εξετάζονται.
Τα εμβόλια ζώντων ιών δεν πρέπει να χορηγούνται κατά τη διάρκεια της θεραπείας και έπειτα, μέχρι την ανάκαμψη των Β-λεμφοκυττάρων.
Αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα
Οι αναστολείς του CYP3A μπορεί να μειώσουν τις συγκεντρώσεις του venetoclax στο πλάσμα. Κατά την έναρξη και κατά τη διάρκεια της φάσης τιτλοποίησης της δόσης: αντενδείκνυται η χρήση ισχυρών αναστολέων του CYP3A λόγω του αυξημένου κινδύνου εμφάνισης TLS και πρέπει να αποφεύγεται η χρήση μέτριων αναστολέων του CYP3A. Εάν πρέπει να χρησιμοποιηθούν μέτριοι αναστολείς του CYP3A, οι γιατροί πρέπει να ανατρέξουν στην Περίληψη των Χαρακτηριστικών του Προϊόντος (ΠΧΠ) για συστάσεις που αφορούν την προσαρμογή της δόσης. Κατά τη λήψη σταθερής ημερήσιας δόσης: Εάν πρέπει να χρησιμοποιηθούν μέτριοι ή ισχυροί αναστολείς του CYP3A, οι γιατροί πρέπει να ανατρέξουν στην πλήρη περίληψη των χαρακτηριστικών του προϊόντος (SmPC) για συστάσεις που αφορούν την προσαρμογή της δόσης.
Πρέπει να αποφεύγεται η ταυτόχρονη χρήση με αναστολείς των P-gp και BCRP κατά την έναρξη και κατά τη διάρκεια της φάσης τιτλοποίησης της δόσης.
Οι επαγωγείς του CYP3A4 μπορεί να μειώσουν τις συγκεντρώσεις του venetoclax στο πλάσμα. Πρέπει να αποφεύγεται η συγχορήγηση με ισχυρούς ή μέτριους επαγωγείς του CYP3A. Αυτοί οι παράγοντες μπορεί να μειώσουν τις συγκεντρώσεις του venetoclax στο πλάσμα.
Δεν συνιστάται η συγχορήγηση δεσμευτικών παραγόντων χολικών οξέων με venetoclax, καθώς αυτό μπορεί να μειώσει την απορρόφηση του venetoclax.
Ανεπιθύμητες ενέργειες
Οι πιο συχνά εμφανιζόμενες ανεπιθύμητες ενέργειες (≥ 20%) οποιουδήποτε βαθμού σε ασθενείς που έλαβαν venetoclax στη μελέτη συνδυαστικής θεραπείας με rituximab ήταν ουδετεροπενία, διάρροια και λοίμωξη του ανώτερου αναπνευστικού συστήματος. Στις μελέτες μονοθεραπείας, οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες ήταν ουδετεροπενία/αριθμός ουδετεροφίλων μειωμένος, διάρροια, ναυτία, αναιμία, κόπωση και λοίμωξη του ανώτερου αναπνευστικού συστήματος.
Οι πιο συχνά εμφανιζόμενες σοβαρές ανεπιθύμητες ενέργειες (≥2%) σε ασθενείς που έλαβαν venetoclax σε συνδυασμό με rituximab ή ως μονοθεραπεία ήταν πνευμονία, εμπύρετη ουδετεροπενία και TLS.
Διακοπή της θεραπείας λόγω ανεπιθύμητων ενεργειών κατεγράφη στο 16% των ασθενών που έλαβαν venetoclax σε συνδυασμό με rituximab και στο 9% των ασθενών που έλαβαν venetoclax ως μονοθεραπεία. Προσαρμογή της δόσης λόγω ανεπιθύμητων ενεργειών κατεγράφη στο 15% των ασθενών που έλαβαν venetoclax σε συνδυασμό με rituximab και στο 2% που έλαβαν venetoclax ως μονοθεραπεία. Διακοπή της δόσης κατεγράφη στο 71% των ασθενών που έλαβαν συνδυαστική θεραπεία του venetoclax με rituximab.
Ειδικοί πληθυσμοί
Ασθενείς με μειωμένη νεφρική λειτουργία (CrCl <80 mL/min) ενδέχεται να απαιτούν εντατικότερη προφύλαξη και παρακολούθηση για να μειωθεί ο κίνδυνος εμφάνισης TLS. Η ασφάλεια σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (CrCl <30 mL/min) ή που βρίσκονται σε αιμοκάθαρση δεν έχει τεκμηριωθεί, και δεν έχει προσδιοριστεί μια συνιστώμενη δόση για αυτούς τους ασθενείς. Το venetoclax πρέπει να χορηγείται σε ασθενείς με σοβαρή νεφρική δυσλειτουργία μόνο εάν το όφελος υπερτερεί του κινδύνου και οι ασθενείς πρέπει να παρακολουθούνται στενά για σημεία τοξικότητας λόγω αυξημένου κινδύνου εμφάνισης TLS.
Το venetoclax μπορεί να βλάψει το έμβρυο όταν χορηγείται σε έγκυες γυναίκες. Οι γυναίκες που θηλάζουν πρέπει να διακόψουν τον θηλασμό κατά τη διάρκεια της θεραπείας.
Το παραπάνω δεν αποτελεί πλήρη περίληψη του συνόλου των πληροφοριών ασφάλειας. Ανατρέξτε στην πλήρη περίληψη των χαρακτηριστικών του προϊόντος venetoclax (SmPC) που είναι διαθέσιμη στον ιστότοπο www.ema.europa.eu. Οι πληροφορίες συνταγογράφησης ποικίλλουν ανά τον κόσμο· ανατρέξτε στην ετικέτα προϊόντος κάθε συγκεκριμένης χώρας για πλήρεις πληροφορίες.
Σχετικά με την AbbVie στην Ογκολογία
Στην AbbVie, καταβάλλουμε κάθε δυνατή προσπάθεια να ανακαλύπτουμε και να αναπτύσσουμε θεραπείες ικανές αν μετασχηματίσουν την θεραπεία στην αντιμετώπιση του καρκίνου, συνδυάζοντας με μοναδικό τρόπο τη βαθιά μας γνώση σε βασικά πεδία της βιολογίας, με πρωτοποριακές τεχνολογίες, καθώς και μέσα από τη σύμπραξη με επιστήμονες, ιατρούς, κλινικούς εμπειρογνώμονες, συναδέλφους στο χώρο της υγεία, ερευνητικά ιδρύματα και συλλόγους ασθενών. Παραμένουμε προσηλωμένοι στην προσπάθεια επίτευξης επαναστατικής προόδου στην θεραπεία ορισμένων από τους πιο εξουθενωτικούς και ευρέως διαδεδομένους τύπους καρκίνου. Παράλληλα, έχουμε δεσμευτεί στη διερεύνηση λύσεων για να βοηθήσουμε τους ασθενείς να αποκτήσουν πρόσβαση στις θεραπείες μας. Με την εξαγορά της Pharmacyclics το 2015 και της Stemcentrx το 2016, τις προσπάθειές μας στο πεδίο της έρευνας και ανάπτυξης, καθώς και μέσω συνεργασιών, το χαρτοφυλάκιο της AbbVie στην ογκολογία αποτελείται σήμερα από θεραπείες που διατίθενται στους ασθενείς και ένα πρόγραμμα κλινικής ανάπτυξης περιλαμβάνει πολλά νέα μόρια τα οποία αξιολογούνται ανά τον κόσμο σε περισσότερες από 200 κλινικές μελέτες και σε περισσότερους από 20 διαφορετικούς τύπους όγκων και αιματολογικών κακοηθειών. Για περισσότερες πληροφορίες, επισκεφθείτε τη διεύθυνση http://www.abbvie.com/oncology.
Σχετικά με την AbbVie
Η AbbVie είναι μία παγκόσμια βιοφαρμακευτική εταιρεία προσανατολισμένη στην έρευνα. Δέσμευση της αποτελεί η ανάπτυξη καινοτόμων, προηγμένων θεραπειών για μερικές από τις πιο σύνθετες και σοβαρές ασθένειες παγκοσμίως. Αποστολή της εταιρείας είναι να αξιοποιήσει την εμπειρία της, τους αφοσιωμένους ανθρώπους της και την μοναδική προσέγγισή της στην καινοτομία, ώστε να βελτιώσει σημαντικά τις θεραπείες σε πέντε βασικούς θεραπευτικούς τομείς: ανοσολογία, αιματολογία, ογκολογία, ιολογία και νευρολογία. Σε περισσότερες από 75 χώρες, οι εργαζόμενοι της AbbVie εργάζονται καθημερινά για να εξελίξουν τις θεραπευτικές επιλογές για τους ανθρώπους παγκοσμίως. Για επιπλέον πληροφορίες παρακαλούμε επισκεφθείτε το www.abbvie.gr. Ακολουθείστε μας στο @abbvie στο Twitter, Facebook, LinkedIn ή Instagram.
###
[1] Seymour JF, Kipps TJ, Eichhorst B, et al. Venetoclax-rituximab in relapsed or refractory chronic lymphocytic leukemia. N Engl J Med. 2018;378(12):1107-1120.
[2] Hallek M, Cheson BD, Catovsky D, et al. Guidelines for diagnosis, indications for treatment, response assessment and supportive management of chronic lymphocytic leukemia. Blood. 2018;806398.
[3] Summary of Product Characteristics for VENCLYXTO. Ludwigshafen, Germany: AbbVie Deutschland GmbH & Co. KG.
[4] NCI dictionary. NCI Dictionary of Terms. Chronic Lymphocytic Leukemia. https://www.cancer.gov/publications/dictionaries/cancer-terms. Accessed September 2018.
[5] World Health Organization. 2014 Review of Cancer Medicines on the WHO List of Essential Medicines. http://www.who.int/selection_medicines/committees/expert/20/applications/CLL.pdf. Accessed September 2018.