Θετικά αποτελέσματα σε μελέτη Φάσης 3 για την ινσουλίνη glargine 300 Units/mL σε παιδιά και εφήβους με διαβήτη τύπου 1

Η Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA) εξέδωσε θετική γνωμοδότηση για τη διευρυμένη ένδειξη χορήγησης της ινσουλίνης glargine 300 Units/mL σε παιδιά και εφήβους (ηλικίας 6 έως 17 ετών) με διαβήτη.
ΠΑΡΙΣΙ – 4 Νοεμβρίου 2019 – Παιδιά και έφηβοι (ηλικίας 6 έως 17 ετών) με διαβήτη τύπου 1 που έλαβαν ινσουλίνη glargine 300 Units/mL, πέτυχαν συγκρίσιμη μείωση των μέσων επιπέδων σακχάρου στο αίμα (γλυκοζυλιωμένη αιμοσφαιρίνη/HbA1c) και εμφάνισαν παρόμοιο κίνδυνο υπογλυκαιμικών επεισοδίων σε σύγκριση με παιδιά και εφήβους που έλαβαν ινσουλίνη glargine 100 Units/mL (Gla-100). Τα παραπάνω αποτελέσματα παρουσιάστηκαν στο 45ο Ετήσιο Συνέδριο της Διεθνούς Εταιρείας για τον Παιδιατρικό και Εφηβικό Διαβήτη, στη Βοστώνη στη Μασαχουσέτης.1
«Γνωρίζουμε καλά ότι η διαχείριση των αυξομειώσεων των επιπέδων σακχάρου στο αίμα προκαλούν ανησυχία στους ανθρώπους με διαβήτη τύπου 1 και αποτελούν σημαντική πρόκληση για τα νεαρά άτομα,» δήλωσε ο καθηγητής Δρ. Thomas Danne, Διευθυντής του Τμήματος Γενικής Παιδιατρικής και Ενδοκρινολογίας/Διαβητολογίας στο Νοσοκομείο Παίδων του Bult της Ιατρικής Σχολής του Ανόβερου στη Γερμανία.
«Πέρα από την ασφάλεια και την αποτελεσματικότητα της ινσουλίνης glargine 300 Units/mL, η μελέτη κατέδειξε αριθμητικά χαμηλότερο ποσοστό ασθενών με σοβαρή υπογλυκαιμία και αριθμητικά χαμηλότερο ποσοστό ασθενών με υπεργλυκαιμία και κέτωση.»
Η κλινική μελέτη EDITION JUNIOR είναι η πρώτη τυχαιοποιημένη, ελεγχόμενη μελέτη που συγκρίνει την ινσουλίνη glargine 300 Units/mL με την ινσουλίνη glargine 100 Units/mL στη συγκεκριμένη ομάδα ασθενών.
Η μελέτη πέτυχε το πρωτεύον καταληκτικό σημείο με συγκρίσιμη μείωση των μέσων επιπέδων σακχάρου στο αίμα σε διάστημα 6 μηνών και με τις δύο θεραπείες και εμφάνιση παρόμοιου κινδύνου υπογλυκαιμικών επεισοδίων.
Το ποσοστό των ασθενών που εμφάνισαν σοβαρή υπογλυκαιμία και το ποσοστό των ασθενών που εμφάνισαν υψηλά επίπεδα σακχάρου στο αίμα (υπεργλυκαιμία) με κέτωση ήταν αριθμητικά χαμηλότερα με την ινσουλίνη glargine 300 Units/mL. Καθώς πρόκειται για σοβαρές βραχυπρόθεσμες επιπλοκές, αυτά τα ευρήματα είναι κλινικά σημαντικά για τα άτομα με διαβήτη τύπου 1.
Με βάση τα παραπάνω δεδομένα, η Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA) εξέδωσε θετική γνωμοδότηση στις 17 Οκτωβρίου, συστήνοντας την επέκταση της υφιστάμενης ένδειξης για την ινσουλίνη glargine 300 Units/mL στην Ευρωπαϊκή Ένωση, για τη θεραπεία του σακχαρώδη διαβήτη σε εφήβους και παιδιά (ηλικίας 6 ετών και άνω).
«Ποσοστό μεταξύ 50% και 80% των νεαρών ατόμων με διαβήτη τύπου 1 παγκοσμίως, χρειάζονται περισσότερες θεραπευτικές επιλογές για να μπορέσουν να πετύχουν μέσα επίπεδα σακχάρου στο αίμα κάτω από 7,5%» δήλωσε ο Dietmar Berger, Global Head of Development της Sanofi. «Κάνοντας αυτό το βήμα προς τη διερεύνηση μιας πρόσθετης επιλογής για τα παιδιά και τους εφήβους με διαβήτη, ελπίζουμε να προσφέρουμε μία ακόμα θεραπεία που θα βοηθήσει τους ασθενείς και τους θεράποντες ιατρούς τους να αναπτύξουν ένα σχέδιο εξατομικευμένης θεραπείας για την καλύτερη διαχείριση της πάθησης.»
Η Ευρωπαϊκή Επιτροπή θα λάβει την τελική απόφαση σχετικά με την πρόσθετη ένδειξη τους επόμενους μήνες.
Σχετικά με τη μελέτη
Η μελέτη EDITION JUNIOR1 συνέκρινε την ινσουλίνη glargine 300 Units/mL με την ινσουλίνη glargine 100 Units/mL σε 463 παιδιά και εφήβους (ηλικίας 6 έως 17 ετών) που λάμβαναν θεραπεία για διαβήτη τύπου 1 για τουλάχιστον ένα έτος και είχαν επίπεδα γλυκοζυλιωμένης αιμοσφαιρίνης (HbA1c) μεταξύ 7,5% και 11,0% κατά την αρχική εκτίμηση. Οι συμμετέχοντες συνέχισαν να λαμβάνουν τη γευματική ινσουλίνη που χρησιμοποιούσαν πριν από την ένταξη στη μελέτη.
Η μελέτη πέτυχε το πρωτεύον καταληκτικό σημείο, επιβεβαιώνοντας τη μη κατωτερότητα της ινσουλίνης glargine 300 Units/mL όσον αφορά στη μείωση των επιπέδων HbA1c έναντι της ινσουλίνης glargine 100 Units/mL μετά από 26 εβδομάδες (μέση μείωση 0,4% έναντι 0,4%· διαφορά: 0,004%, 95% Διάστημα Εμπιστοσύνης [CI] -0,17 έως 0,18· το ανώτατο όριο ήταν κάτω από το προκαθορισμένο περιθώριο μη κατωτερότητας του 0,3%).
Κατά το ίδιο χρονικό διάστημα, συγκρίσιμος αριθμός ασθενών εμφάνισε ένα ή περισσότερα επιβεβαιωμένα επεισόδια υπογλυκαιμίας οποιαδήποτε στιγμή της ημέρας. Αριθμητικά λιγότεροι ασθενείς που έλαβαν ινσουλίνη glargine 300 Units/mL εμφάνισαν σοβαρή υπογλυκαιμία ή εμφάνισαν ένα ή περισσότερα επεισόδια υπεργλυκαιμίας με κέτωση σε σύγκριση με τους ασθενείς που έλαβαν ινσουλίνη glargine 100 Units/mL.
Το ποσοστό των ανεπιθύμητων ενεργειών ήταν συγκρίσιμο μεταξύ των δύο ομάδων θεραπείας (65,2% έναντι 65,8% των ασθενών ανέφερε οποιαδήποτε ανεπιθύμητη ενέργεια που σχετίζεται με τη θεραπεία). Δεν αναφέρθηκε κανένα μη αναμενόμενο ζήτημα ασφάλειας, με βάση τα καθιερωμένα προφίλ και των δύο προϊόντων.
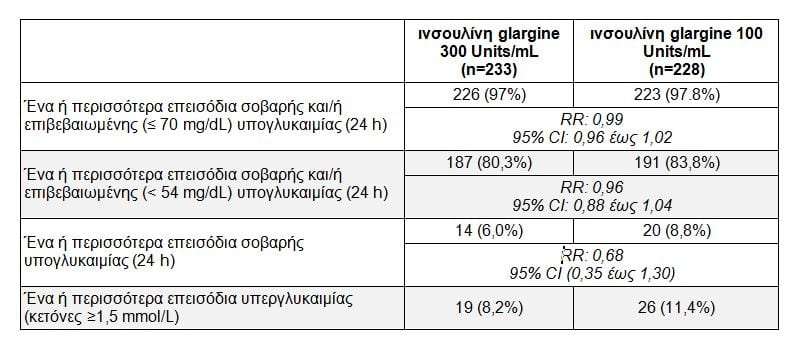

Ο σχεδιασμός της μελέτης περιλαμβάνει επίσης μία πρόσθετη περίοδο διάρκειας 6 μηνών για την παρακολούθηση της ασφάλειας. Τα σχετικά αποτελέσματα θα ανακοινωθούν ξεχωριστά.
Παραπομπές
1. Danne T et al., “Insulin Glargine 300 U/mL (Gla-300) provides effective glycemic control in youths with type 1 diabetes (T1D): the EDITION JUNIOR study”, Poster presentation P240, ISPAD 45th Annual Conference, Boston MA, U.S., October 31, 2019. Available via http://www.professionalabstracts.com/ispad2019/Iplanner/#/presentation/216 [Πρόσβαση Οκτώβριος 2019].







